
科目: 来源: 题型:
【题目】下列情况,离子可能大量共存的是( )
A.Al3+、Na+、Cl-、CO32-
B.25℃,水电离出的OH-浓度为10-11mol/L的溶液中:K+、Na+、SO32-、NO3-
C.![]() =10-2溶液中:Cu2+、Na+、Cl-、NO3-
=10-2溶液中:Cu2+、Na+、Cl-、NO3-
D.无色溶液中:H+、Fe2+、Cl-、NH4+
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定镁铝合金(不含其它元素)中铝的质量分数,甲乙两个学习小组设计了下列二种不同的实验方案进行探究。请回答下列问题:
(一)甲组:实验方案:镁铝合金![]() 测定剩余固体质量
测定剩余固体质量
实验步骤:
①称量:托盘天平称量2.7g镁铝合金粉末
②溶解:将①中药品加入烧杯中,用量筒量取至少_____mL 1mol/L NaOH 溶液加入烧杯中,不断搅拌,充分反应
③过滤:
④洗涤:若未对过滤所得固体进行洗涤,测得铝的质量分数将_____(填“偏高”、“偏低”或“不变”),证明固体已洗涤干净的方法为_________________________
⑤干燥、称量剩余固体
(二)乙组:

实验装置如图,实验步骤如下:
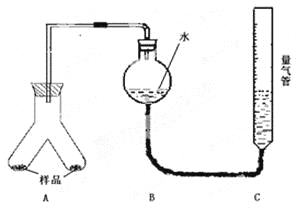
①按图连接好装置;
②称取两份质量均为0.3g 的镁铝合金样品粉末,分别放入A装置左右两个管中,向B装置中加入一定量的水,把装置A、B的胶塞塞好,然后调节C的高度使B和C中的液面相平,记录下此时的体积为112 mL;
③通过注射器的针头向装置A左侧管中注入足量的稀盐酸,等不再有气泡产生时,调节装置C的高度,使B和C中的液面相平时记录下此时的体积为448mL;
④通过另一针头向装置A右侧管中加入足量的稀NaOH溶液,等不再有气泡产生时,调节装置C的高度,使B和C中的液面相平时记录下此时的体积为672mL。
问题和讨论:
(1)上述实验步骤①和②之间必须加一步________的操作,具体方法为________________________。
(2)为使气体体积测定结果不至于引起很大偏差,除了应注意使B和C中的液面相平外,在反应完全后至读数之前,还需要注意的关键问题是(有几点写几点)_______。
(3)计算合金中铝的质量分数时,是否需要将气体体积折算为标准状况的体积____,试根据题中数据计算出合金中铝的质量分数为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述不相符的是

A. 图甲表示反应:4CO(g)+2NO2(g)![]() N2(g)+4CO2(g)ΔH <0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,K1>K2
N2(g)+4CO2(g)ΔH <0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,K1>K2
B. 图乙表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(g)的影响,乙的压强比甲的压强大
3C(g)+D(g)的影响,乙的压强比甲的压强大
C. 图丙表示的反应是吸热反应,该图表明催化剂不能改变化学反应的焓变
D. 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)![]() N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
查看答案和解析>>
科目: 来源: 题型:
【题目】富马酸亚铁,是一种治疗缺铁性贫血的安全有效的铁制剂。富马酸在适当的pH条件下与![]() ,反应得富马酸亚铁。
,反应得富马酸亚铁。
已知:
物质名称 | 化学式 | 相对分子质量 | 电离常数(25℃) |
富马酸 |
| 116 |
|
碳酸 |
|
| |
富马酸亚铁 | FeC4H2O4 | 170 |
i.制备富马酸亚铁:
①将富马酸置于100mL烧杯A中,加热水搅拌
②加入![]() 溶液10mL使溶液pH为6.5-6.7。并将上述溶液移至100mL容器B中
溶液10mL使溶液pH为6.5-6.7。并将上述溶液移至100mL容器B中
③安装好回流装置C,加热至沸。然后通过恒压滴液漏斗D缓慢加入![]() 溶液30mL
溶液30mL
④维持反应温度100℃,充分搅拌1.5小时。冷却,减压过滤,用水洗涤沉淀
⑤最后水浴干燥,得棕红(或棕)色粉末,记录产量
请回答以下问题:
(1)该实验涉及到的主要仪器需从以上各项选择,则B为__________(填字母),C为___________(填名称)。
(2)已知反应容器中反应物![]() 和富马酸按恰好完全反应的比例进行起始投料,写出步骤②中加入
和富马酸按恰好完全反应的比例进行起始投料,写出步骤②中加入溶液调节pH的目的是______________________________________________;若加入
![]() 溶液过量,溶液pH偏高,则制得产品的纯度会_____________(填“偏高”“偏低”或“无影响”)。
溶液过量,溶液pH偏高,则制得产品的纯度会_____________(填“偏高”“偏低”或“无影响”)。
(3)配制![]() 溶液方法为称取
溶液方法为称取![]() 固体,溶于30mL新煮沸过的冷水中,需用新煮沸过的冷水的原因是____________________________________________________________________________。
固体,溶于30mL新煮沸过的冷水中,需用新煮沸过的冷水的原因是____________________________________________________________________________。
(4)步骤④中洗涤的目的主要是为了除去是___________离子,检验沉淀是否洗净的方法是:_____________。
ii.计算产品的产率:
(5)经测定,产品中富马酸亚铁的纯度为76.5%。以5.80g富马酸为原料反应制得产品8.10g,则富马酸亚铁的产率为_____________%。(保留小数点后一位)
查看答案和解析>>
科目: 来源: 题型:
【题目】液氨与水性质相似,也存在微弱的电离:2NH3![]() NH4++NH2—,其离子积常数K=c(NH4+)·c(NH2—)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
NH4++NH2—,其离子积常数K=c(NH4+)·c(NH2—)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
A. 液氨的电离平衡 B. 液氨的离子积常数
C. c(NH4+) D. c(NH2—)
查看答案和解析>>
科目: 来源: 题型:
【题目】425℃时,在两个1L密闭容器中分别发生化学反应,物质的浓度随时间的变化如图所示。下列叙述错误的是( )
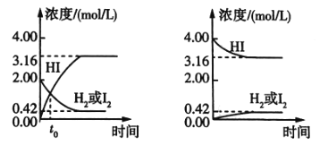
A.图①中t0时,三种物质的物质的量相等
B.图①中![]() 时,反应达到平衡状态
时,反应达到平衡状态
C.图②中的可逆反应为2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)
D.图①②中,当c(HI)=3.16mol/L时,两容器中的反应均达到平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】在298 K、1.01×105 Pa,将22 g CO2通入0.75 L 1.0 mol·L-1NaOH溶液中充分反应,测得反应放出的热量为a kJ。已知该条件下1 mol CO2通入1 L 2.0 mol·L-1NaOH溶液中充分反应放出的热量为b kJ。则CO2与NaOH反应生成NaHCO3的热化学方程式为( )。
A. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=-(2b-a) kJ·mol-1
NaHCO3(aq) ΔH=-(2b-a) kJ·mol-1
B. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=+(4a-b) kJ·mol-1
NaHCO3(aq) ΔH=+(4a-b) kJ·mol-1
C. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=-(4a-b) kJ·mol-1
NaHCO3(aq) ΔH=-(4a-b) kJ·mol-1
D. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=+(2b-a) kJ·mol-1
NaHCO3(aq) ΔH=+(2b-a) kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】某密闭容器中充入一定量SO2、O2发生反应2SO2(g)+O2(g)![]() 2SO3(g), 测得SO3浓度与反应温度关系如图.下列说法正确的是
2SO3(g), 测得SO3浓度与反应温度关系如图.下列说法正确的是
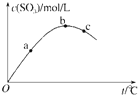
A. 该反应△H>0 B. SO2转化率:a>b>c
C. 化学反应速率:c>b>a D. 平衡常数K:b>c>a
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关滴定的说法正确的是( )
A. 用25mL滴定管进行中和滴定时,用去标准液的体积为21.7mL
B. 用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中有NaOH杂质,则结果偏低
C. 用C1mol/L酸性高锰酸钾溶液滴定V2mL未知浓度的H2C2O4溶液,至滴定终点用去酸性高猛酸钾溶液体积为V1mL,则H2C2O4溶液的浓度为![]() mol/L
mol/L
D. 用未知浓度的盐酸滴定已知浓度的NaOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏低
查看答案和解析>>
科目: 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
![]() 第一份加入
第一份加入![]() 溶液有沉淀产生;
溶液有沉淀产生;
![]() 第二份加足量NaOH溶液加热后,收集到气体
第二份加足量NaOH溶液加热后,收集到气体![]() ;
;
![]() 第三份加足量
第三份加足量![]() 溶液后,得干燥沉淀
溶液后,得干燥沉淀![]() ,经足量盐酸洗涤、干燥后,沉淀质量为
,经足量盐酸洗涤、干燥后,沉淀质量为![]() 根据上述实验,回答下列问题
根据上述实验,回答下列问题
(1)该溶液中一定存在的离子是______,可能存在的离子是______.
(2)求一定存在的离子中阳离子的浓度或浓度的取值范围______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com