
科目: 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g) +![]() O2(g) = H2O(l)△H = -285.8 kJ / mol
O2(g) = H2O(l)△H = -285.8 kJ / mol
②C(s) + O2(g) = CO2(g)△H = -393.5 kJ / mol
③C(s) + H2O(g) = CO(g) + H2(g)△H = +131.5 kJ/mol
请回答:
(1)上述反应中属于放热反应的是______(填序号,下同),属于吸热反应的是____。
(2)1 mol H2完全燃烧生成液态水,放出的热量为____kJ。
(3)写出下列反应的热化学方程式
①1molN2(g)与适量O2(g)反应生成NO(g),需吸收68 kJ的热量;
_______________________________________________
②2 molCu(s) 与适量O2(g)反应生成CuO(s),放出314 kJ热量;
_______________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】偏二甲肼与![]() 是常用的火箭推进剂,二者发生如下化学反应:
是常用的火箭推进剂,二者发生如下化学反应:
![]()
![]()
(1)火箭残骸中常现红棕色气体,原因为:![]()
![]()
当温度升高时,气体颜色变深,则反应![]() 为____
为____![]() 填“吸热”或“放热”
填“吸热”或“放热”![]() 反应。
反应。
(2)在一个体积为1L的恒压密闭容器中充入![]() ,一段时间后达化学平衡状态,反应的化学平衡常数表达式
,一段时间后达化学平衡状态,反应的化学平衡常数表达式![]() _________;反应3s后
_________;反应3s后![]() 的物质的量为
的物质的量为![]() ,则
,则![]() 内的平均反应速率
内的平均反应速率![]() ______
______
(3)在![]() 的平衡体系中,回答下列问题:
的平衡体系中,回答下列问题: ![]() 填“正向”、“逆向”、“不”
填“正向”、“逆向”、“不”![]()
①在溶液中加入少量的KSCN固体,平衡____移动。
②在溶液中加入少量的NaOH固体,平衡_____移动。
查看答案和解析>>
科目: 来源: 题型:
【题目】酪醇是合成药物的中间体。由芳香化合物A为原料制备酪醇的一种合成路线如图:
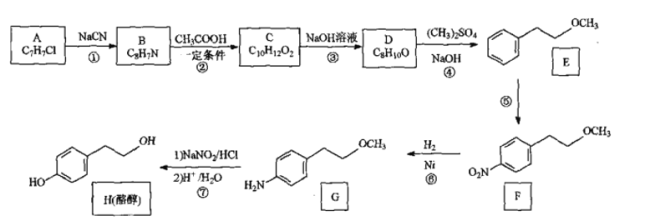
已知:
回答下列回题:
(1)B的结构简式为_____________________。
(2)F中的官能团的名称为__________________。
(3)写出C→D的化学方程式:___________________________。
(4)反应④的反应类型是_______________________________。
(5)反应⑤所需的试剂和条件是_________________________________。
(6)C的一种同分异构体,能发生银镜反应和水解反应,其核磁共振氢谱有4组峰,面积比为6:3:2:1,写出一种符合要求的同分异构体的结构简式:_____________。
(7)已知: ![]() (苯胺)易被氧化。设计以甲苯为原料制备2,4,6一三羟基苯甲酸的合成路线:____________________________________________________ (无机试剂任用)。
(苯胺)易被氧化。设计以甲苯为原料制备2,4,6一三羟基苯甲酸的合成路线:____________________________________________________ (无机试剂任用)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组研究溶液中Fe2+与![]() 、
、![]() 的反应。
的反应。
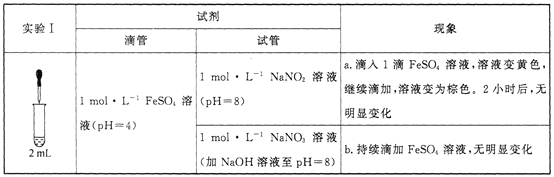
已知:[Fe(NO)]2+在溶液中呈棕色。
(1)研究现象a中的黄色溶液。
①用__________溶液检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是_____________。
③进行实验Ⅱ,装置如图所示。左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为NO。产生NO的电极反应式为_______实验Ⅱ的目的是________。
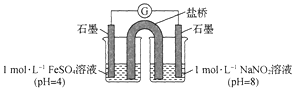
(2)研究现象a中的棕色溶液。综合实验I和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是_______。
(3)研究酸性条件下,溶液中Fe2+与![]() 、
、![]() 的反应。
的反应。
序号 | 操作 | 现象 |
i | 取1 mol·L-l的NaNO2溶液,加稀硫酸至pH = 3,加入1 mol·L-l FeSO4溶液 | 溶液立即变为棕色 |
ii | 取1 mol·L-l的NaNO3溶液,加硫酸至pH = 3,加入1 mol·L-l FeSO4溶液 | 无明显变化 |
iii | 分别取0.5 mL l mol·L-l的NaNO3溶液与1 mol·L-l的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
i中溶液变为棕色的离子方程式为_______、__________。
实验结论:本实验条件下,溶液中![]() 、
、![]() 的氧化性与溶液的酸碱性等有关。
的氧化性与溶液的酸碱性等有关。
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸(HOOC-COOH)是一种常见的有机酸,利用淀粉制备草酸的实验流程如图:
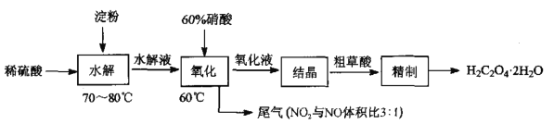
回答下列问题:
(1)“水解”时,检验淀粉是否水解完全,所用的试剂是____;“水解”及“氧化”步骤中适宜的加热方式是________________。
(2)“氧化”时实验装置如图所示(夹持及加热装置已略):
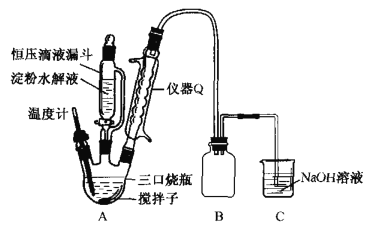
①仪器Q的名称是________.
②三口烧瓶中生成H2C2O4· 2H2O的化学方程式为____________。
③装置B的作用是___________,装置C的作用是_______________。
(3)已知在20℃、70℃时,草酸的溶解度依次为为9. 5 g/(l00g水),84.5g/(l00g水),则粗草酸“精制”需采用的提纯方法为___________________。
(4)探究H2C2O4的性质:
①向NaHCO3溶液中加入草酸溶液,产生大量气体,可得出草酸的酸性比碳酸_____(填“强”或“弱”)。
②向草酸中加入足量C2H5OH和适量浓硫酸加热,产生有芳香气味的油状物。该生成物为___________(写结构简式)。
③向K2Cr2O7溶液中加入H2C2 O4·2H2O析出K[Cr(C2O4)2(H2O)2]晶体,该反应的化学方程式为_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】丙烯可用于合成应用广泛的DAP树脂单体和聚碳酸酯。下列反应流程中的反应条件和部分副产物已省略。
已知:Ⅰ.RCOOR′+R″OH→RCOOR″+R′OH(R、R′、R″代表烃基)
Ⅱ.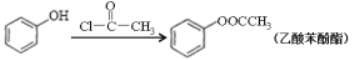
III.生成D与F的过程中,两种反应物的比值不相同
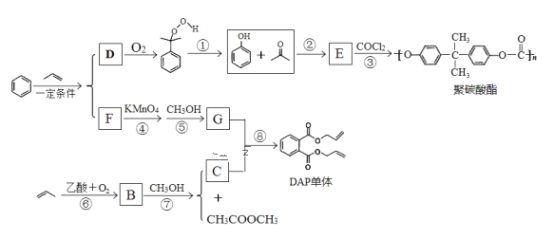
请回答下列问题:
(1)聚碳酸酯的分子式为_______________;反应③的反应类型________________。
(2)E的结构简式______________;B中所含官能团的名称是___________。
(3)下列说法正确的是_______。
a.C能发生聚合反应、加成反应和酯化反应
b.E能与FeCl3溶液发生显色反应,易溶于乙醇
c.D能与溴水发生化学反应而使溴水褪色,也能使酸性高锰酸溶液褪色
d.COCl2与![]() 结构相似,两种物质的所有原子均共平面
结构相似,两种物质的所有原子均共平面
(4)写出反应⑧的化学方程式_________________。
(5)写出同时符合下列条件的乙酸苯酚酯的所有同分异构体的结构简式_________________两种即可)。
ⅰ.能发生银镜反应;ⅱ.苯环上的一氯代物有两种。
(6)聚酯纤维是目前产量最高的一种合成纤维,其化学名称为聚对苯二甲酸乙二酯,请设计以乙烯和苯为原料 制备该树脂的合成路线,用流程图表示,无机试剂任选,注明试剂和反应条件。__________________
查看答案和解析>>
科目: 来源: 题型:
【题目】N、O、S、Cl、Cu五种元素的单质及其化合物在现代工业生产中有着广泛应用。请回答下列问题:
(1)第一电离能:N_____O(填“![]() ”或“
”或“![]() ”,下同),电负性:S____Cl。
”,下同),电负性:S____Cl。
(2)![]() 的沸点比
的沸点比![]() 高的原因是___________;
高的原因是___________;![]() 属于________(填“极性”或“非极性”)分子,
属于________(填“极性”或“非极性”)分子,
(3)Cu与Cl形成化合物的晶胞如图所示。该晶体的化学式为________。
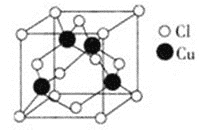
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实可以用勒夏特列原理解释的是
A. 高锰酸钾溶液与草酸发生化学反应刚开始缓慢,随后反应迅速加快
B. 实验室采用排饱和食盐水的方法收集氯气(Cl2+H2O![]() HCl+HClO)
HCl+HClO)
C. 500 ℃左右的温度比室温更有利于合成氮反应N2(g)+ 3H2 (g)![]() 2NH3(g) △H<0
2NH3(g) △H<0
D. FeCl3+3KSCN![]() Fe(SCN)3+3KCl, 增大KCl的浓度则溶液的颜色变浅
Fe(SCN)3+3KCl, 增大KCl的浓度则溶液的颜色变浅
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖由约翰·B·古迪纳夫、M·斯坦利·威廷汉、吉野彰三人分获,以表彰他们研究锂离子电池做出的贡献。锂离子正极材料有LiMO2(M=Co、Ni、Mn) .
回答下列问题:
(1)基态Co原子价电子排布式为______,基态Li原子核外电子运动状态有____种。
(2)锂离子电池电解常用的锂盐有LiClO4、LiBF4等,常采用有机溶剂有乙醚、丙烯酯(![]() )等。
)等。
①LiClO4中阴离子空间构型为______,与其键合方式相同、空间构型也相同的离子和分子是___________________________ (各举一例).
②Li、Cl、F、B的电负性从大到小的顺序为_____;丙烯碳酸酯中碳原子的杂化方式是____。
③C2H5OC2H5(乙醚)的沸点比乙醇的低,其原因是________________。
(3)LiCoO2的晶胞是六棱柱,其结构如图所示:

晶胞中含氧原子数为_____,若晶胞的底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,则LiCoO2的密度为_______g·cm —3(列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】稀土是一种重要的战略资源。氟碳铈矿主要化学成分为CeFCO3,它是提取铈等稀土元素的重要矿物原料。氟碳铈矿的冶炼工艺流程如下:
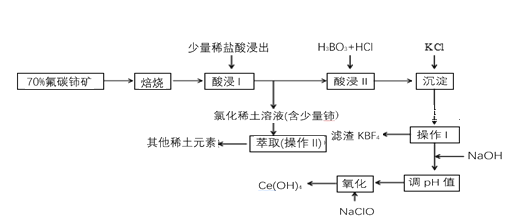
已知:i.铈的常见化合价为+3、+4。焙烧后铈元素转化成CeO2和CeF4。四价铈不易进入溶液,而三价稀土元素易进入溶液。
ii.酸浸II中发生反应:9CeO2+3CeF4+45HCl+3H3BO3=Ce(BF4)3↓+11CeCl3+6Cl2↑+27H2O
请回答下列问题:
(1)①焙烧氟碳铈矿的目的是_______。
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:________。
CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:________。
(2)在酸浸I中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。少量铈进入稀土溶液发生反应的离子方程式是________。
(3)向Ce(BF4)3中加入KCl溶液的目的是______。
(4)操作I的名称为_______,在实验室中进行操作II时所需要的硅酸盐仪器有_______。
(5)“操作I”后,向溶液中加入NaOH溶液来调节溶液的pH,以获得Ce(OH)3沉淀,常温下加入NaOH调节溶液的pH应大于________即可认为Ce3+已完全沉淀。(已知:Ksp[Ce(OH)3]=1.0×10-20)
(6)取上述流程中得到的Ce(OH)4产品5.000g,加酸溶解后,向其中加入含0.03300mol FeSO4的FeSO4溶液使Ce4+全部被还原成Ce3+,再用0.1000mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00mL标准溶液。则该产品中Ce(OH)4的质量分数为______(已知氧化性:Ce4+>KMnO4;Ce(OH)4的相对分子质量为208,保留3位有效数字)。
(7)在酸性条件下电解Ce2O3制备Ce(SO4)2(如下图),阳极电极反应式_______。
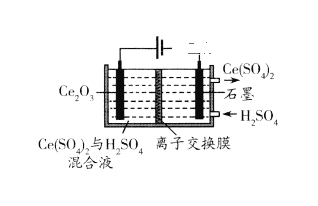
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com