
科目: 来源: 题型:
【题目】用如图所示装置探究碳酸和苯酚的酸性强弱,下列叙述不正确的是(部分夹持仪器省略) ( )
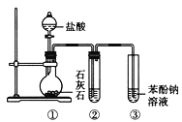
A.②中试剂为饱和Na2CO3溶液
B.打开分液漏斗旋塞,①中产生无色气泡,③中出现白色浑浊
C.苯酚有弱酸性,是由于苯基影响了与其相连的羟基的活性
D.③中反应:2![]() +CO2+H2O→2
+CO2+H2O→2![]() +Na2CO3
+Na2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组用下图所示装置制备NaNO2并对其性质作如下探究(A中加热装置已略去)。
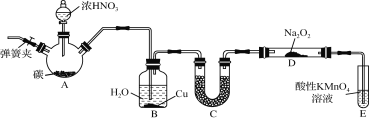
【背景素材】
①2NO+Na2O2=2NaNO2;
②NO能被酸性KMnO4氧化成NO![]() ,MnO
,MnO![]() 被还原为Mn2+。
被还原为Mn2+。
③在酸性条件下NaNO2能把I-氧化为I2;S2O32-能把I2还原为I-。
【制备NaNO2】
(1) 装置A三颈烧瓶中发生反应的化学方程式为 。
(2) B装置的目的是① ,② 。
(3) 为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是 (填序号)。
A. P2O5 B. 碱石灰 C. 无水CaCl2 D. 生石灰
(4) E装置发生反应的离子方程式是 。
【测定NaNO2纯度】
(5) 本小题可供选择的试剂有:
A.稀硫酸
B.c1mol·L-1KI溶液
C.淀粉溶液
D.c2mol·L-1Na2S2O3溶液
E.c3mol·L-1酸性KMnO4溶液
①利用NaNO2的还原性来测定其纯度,可选择的试剂是 (填序号)。
②利用NaNO2的氧化性来测定其纯度的步骤是:准确称取质量为m g的NaNO2样品放入锥形瓶中,加适量水溶解 (请补充完整实验步骤)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是部分短周期元素的常见化合价与原子序数的关系图:

(1)元素A在周期表中的位置__________________________。
(2)用电子式表示D2G的形成过程____________________________,其所含化学键类型为___________。
(3)C2-、D+、G2-离子半径由大到小顺序是____________________(用离子符号回答)。
(4)某同学设计实验证明A、B、F的非金属性强弱关系。
①溶液a和b分别为______________,________________。
②溶液c中的离子方程式为________________________________________。

(5)将0.5 mol D2C2投入100 mL 3 mol/L ECl3溶液中:
①转移电子的物质的量为_____________________________________。
②用一个离子方程式表示该反应__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图装置,电流表G发生偏转,a极逐渐变粗,同时b极逐渐变细,c为电解质溶液,则a、b、c可能是下列各组中的( )

A.a是Ag、b是Fe、c为AgNO3溶液B.a是Ag、b是Cu、c为Cu(NO3)2溶液
C.a是Zn、b是Cu、c为稀H2SO4D.a是Cu、b是Zn、c为稀H2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)按要求写出电子式:CO2_________ COCl2_________ NaCN______ N2H![]() _______
_______
(2)元素周期表中“对角线规则”是指处于周期表中对角线位置(左上和右下方)的两元素,其性质具有相似性,例如:Be和Al处于对角线位置。写出Be与氢氧化钠溶液反应的化学方程式:_________________________________。
(3)写出氢,氧,钠,硫四种元素组成的两种酸式盐发生复分解反应的离子方程式:___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在25 ℃条件下向10.00 mL 0.1 mol·L-1HCOOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如下图所示(忽略温度变化)。下列说法中不正确的是( )
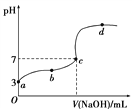
A. a点表示的溶液中c(HCOO-)约为10-3 mol·L-1
B. 用25 mL的酸式滴定管量取HCOOH溶液
C. c点NaOH溶液的体积小于10 mL
D. 在a、c间任一点,溶液中一定都有c(Na+)>c(HCOO-)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲胺![]() 为一元弱碱,在水中的电离方式与氨相似。已知:
为一元弱碱,在水中的电离方式与氨相似。已知:![]() 时,
时,![]() 的电离常数
的电离常数![]() 。
。![]() 时,用
时,用![]() 的稀硫酸滴定
的稀硫酸滴定![]() 的二甲胺溶液,溶液中
的二甲胺溶液,溶液中![]() 的物质的量浓度的负对数
的物质的量浓度的负对数![]() 与所加稀硫酸的体积
与所加稀硫酸的体积![]() 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
A.已知![]() ,则A点溶液的pH约为
,则A点溶液的pH约为![]()
B.C点溶液中存在![]()
C.B点溶液中存在![]()
D.A、B、C、D四点溶液中,水电离出来的![]() :
:![]()
查看答案和解析>>
科目: 来源: 题型:
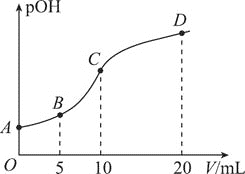
【题目】25℃时,用浓度为0.01mol·L-1的HA溶液滴定20mL浓度为0.01mol·L-1的NaOH溶液,滴定曲线如图所示。下列说法错误的是( )

A. 应选用酚酞作指示剂
B. M点溶液中存在:c(Na+)>c(A-)
C. Ka(HA)≈2×10-8
D. N点溶液中存在:c(OH-)-c(H+)=c(HA)
查看答案和解析>>
科目: 来源: 题型:
【题目】随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
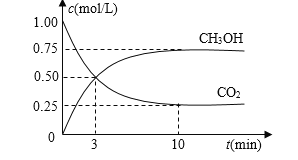
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____mol/(L·min)。
②该反应的平衡常数表达式为K=_________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
⑵有人提出,可以设计反应2CO(g)=2C(s)+O2(g) 通过其自发进行来消除CO的污染。该方案_______(填“是”、“否”)可行,理由是:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向![]() 的二元酸
的二元酸![]() 溶液中滴加
溶液中滴加![]() 溶液,溶液中含A元素的粒子的物质的量随NaOH溶液的体积变化如图,y点对应溶液的
溶液,溶液中含A元素的粒子的物质的量随NaOH溶液的体积变化如图,y点对应溶液的![]() 。下列说法中不正确的是
。下列说法中不正确的是 ![]()
![]()
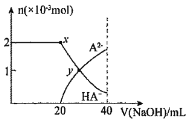
A.二元酸![]() 的电离方程式为:
的电离方程式为:![]()
![]()
B.当溶液中![]() 和NaHA物质的量相等时:
和NaHA物质的量相等时:![]()
C.在x点溶液中离子浓度大小关系:![]()
D.常温下![]() 的电离常数为
的电离常数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com