
科目: 来源: 题型:
【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
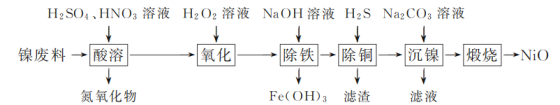
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是________。
(2) “氧化”时,Fe2+参加反应的离子方程式为________。
(3) “除铁”时需控制溶液的pH范围为________。
(4) “滤渣”的主要成分为________(填化学式)。
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以NA表示阿伏伽德罗常数的数值,下列说法不正确的是( )
A.1 L1mol/L H2SO4,含有2NA个H+
B.500mL2mol/L盐酸比100mL2mol/L硫酸的导电性强
C.1mol Na2S2,含NA个共价键
D.标准状况下,3.36 LSO2的质量约为9.6g
查看答案和解析>>
科目: 来源: 题型:
【题目】石棉尾矿主要含有![]() 和少量的
和少量的![]() 、
、![]() 以石棉尾矿为镁源制备碳酸镁晶体
以石棉尾矿为镁源制备碳酸镁晶体![]() 的工艺如下:
的工艺如下:
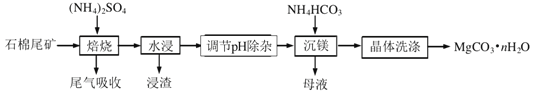
已知“焙烧”过程中的主反应为:![]()
![]() 写出焙烧产物
写出焙烧产物![]() 的电子式______。
的电子式______。
![]() 为提高水浸速率,可采取的措施为______
为提高水浸速率,可采取的措施为______![]() 任写一条
任写一条![]() ,“浸渣”的主要成分为____。
,“浸渣”的主要成分为____。
![]() “调节pH除杂”时,需将pH调至
“调节pH除杂”时,需将pH调至![]() ,则除去的杂质离子是______,此时溶液中的
,则除去的杂质离子是______,此时溶液中的![]() ______
______![]() 已知
已知![]() 。
。
![]() “沉镁”过程中反应的离子方程式为______。
“沉镁”过程中反应的离子方程式为______。
“沉镁”时若温度超过![]() ,将产生较多的碱式碳酸镁杂质,原因是______
,将产生较多的碱式碳酸镁杂质,原因是______
![]() 流程中可以循环利用的物质是______
流程中可以循环利用的物质是______![]() 填化学式
填化学式![]() 。
。
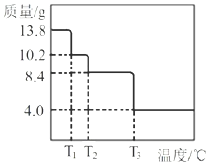
![]() 某小组同学称取
某小组同学称取![]()
![]() 进行热重分析,并绘制剩余固体质量随温度化的曲线如图所示,则
进行热重分析,并绘制剩余固体质量随温度化的曲线如图所示,则![]() ______。
______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质性质的叙述一定不正确的是
A. 向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
B. KAl(SO4) 2·12H2O溶于水可形成 Al(OH)3胶体
C. NH4Cl与Ca(OH)2混合加热可生成NH3
D. Cu与FeCl3溶液反应可生成CuCl2
查看答案和解析>>
科目: 来源: 题型:
【题目】工业生产中产生的![]() 、NO直接排放将对大气造成严重污染,利用电化学原理吸收
、NO直接排放将对大气造成严重污染,利用电化学原理吸收![]() 和NO,同时获得
和NO,同时获得![]() 和
和![]() 产品的工艺流程图如下
产品的工艺流程图如下![]() 为铈元素
为铈元素![]() 。
。
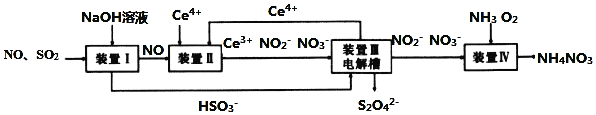
请回答下列问题.
![]() 若装置Ⅱ中反应生成的含氮化合物的物质的量比为1:1,则该反应的离子方程式____。
若装置Ⅱ中反应生成的含氮化合物的物质的量比为1:1,则该反应的离子方程式____。
![]() 含硫各微粒
含硫各微粒![]() 、
、![]() 和
和![]() 存在于
存在于![]() 与NaOH溶液反应后的溶液中,它们的物质的量分数
与NaOH溶液反应后的溶液中,它们的物质的量分数![]() 与溶液pH的关系如图所示。
与溶液pH的关系如图所示。
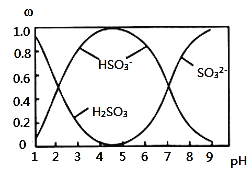
![]() 下列说法中正确的是______
下列说法中正确的是______![]() 填标号
填标号![]() 。
。
A.![]() 溶液中滴加氯水可以使
溶液中滴加氯水可以使![]() 的值变大
的值变大
B.![]() 时,溶液中
时,溶液中![]()
C.![]() 时的溶液中
时的溶液中![]()
D.由图中数据,可以估算出![]() 的第二级电离平衡常数
的第二级电离平衡常数![]()
E.由图中数据,![]() 和
和![]() 时的溶液中水的电离程度相同
时的溶液中水的电离程度相同
![]() 若利用氨水吸收二氧化硫,其相关反应的主要热化学方程式如下:
若利用氨水吸收二氧化硫,其相关反应的主要热化学方程式如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
反应![]() ___
___![]() 。
。
![]() 取装置Ⅰ中的吸收液VmL,用
取装置Ⅰ中的吸收液VmL,用![]() 的酸性高锰酸钾溶液滴定.吸收液溶液应装在______
的酸性高锰酸钾溶液滴定.吸收液溶液应装在______![]() 填“酸式”或“碱式”
填“酸式”或“碱式”![]() 滴定管中,判断滴定终点的方法______。
滴定管中,判断滴定终点的方法______。
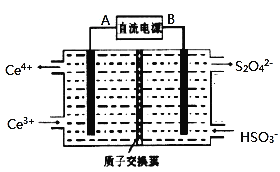
![]() 装置Ⅲ的作用之一是再生
装置Ⅲ的作用之一是再生![]() ,其原理如图所示,图中B为电源的______
,其原理如图所示,图中B为电源的______![]() 填“正”或“负”
填“正”或“负”![]() 极,左侧反应室中发生的主要电极反应式为______。
极,左侧反应室中发生的主要电极反应式为______。
![]() 已知进入装置Ⅳ的溶液中
已知进入装置Ⅳ的溶液中![]() 的浓度为
的浓度为![]() ,要使
,要使![]() 该溶液中的
该溶液中的![]() 完全转化为
完全转化为![]() ,该过程中转移电子数目为______。
,该过程中转移电子数目为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】方程式书写:
(1)S+Ca(OH)2—CaS5+CaS2O3+H2O___。
(2)H2O2+Cr2(SO4)3+ —K2SO4+K2CrO4+H2O___。
(3)氯酸镁加入含有KSCN的酸性硫酸亚铁溶液中立即出现红色,写出相关反应的离子方程式___。
(4)写出用氯化铁溶液浸取辉铜矿石(主要成分是Cu2S)发生反应的离子方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】微型银-锌电池可用作电子仪器的电源,其电极分别是![]() 和
和![]() ,电解质为
,电解质为![]() 溶液,电池总反应为
溶液,电池总反应为![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.电池工作过程中,![]() 溶液浓度降低
溶液浓度降低
B.电池工作过程中,电解液中![]() 向正极迁移
向正极迁移
C.负极发生反应![]()
D.正极发生反应![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】在体积相同的两个密闭容器中分别充满NO2、N2O4气体,当这两个容器内温度和气体密度相等时,下列说法正确的是
A.两种气体的压强相等B.两种气体N原子为1:2
C.两种气体的分子数目相等D.两种气体的氧原子数目相等
查看答案和解析>>
科目: 来源: 题型:
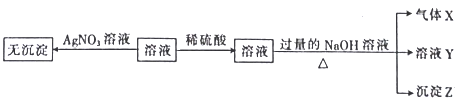
【题目】某强酸性无色溶液中可能含下表中的若干种离子。
阳离子 | Mg2+、NH |
阴离子 | SiO |
实验I:取少量该溶液进行如图实验。
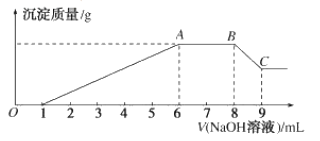
实验II:为了进一步确定该溶液的组成,取200mL原溶液,向该溶液中滴加2molL-1的NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。
回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有___种。
(2)通过实验I可以确定该溶液中一定存在的阴离子是___。
(3)写出实验II的图像中BC段对应的离子方程式:___。
(4)A点对应的固体质量为___ g。
(5)该溶液中阴离子的浓度为___ molL-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mgcm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
[配制KMnO4标准溶液]如图是配制100mLKMnO4标准溶液的过程示意图。
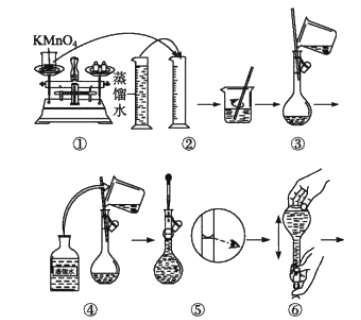
(1)根据图示判断,其中不正确的操作有___(填序号)。
(2)其中确定100mL溶液体积的容器是___(填名称)。
(3)如果忘记洗涤烧杯,所配制的溶液浓度将___;如果定容时仰视,所配制的溶液浓度将___(填“偏大”或“偏小”)。
[测定血液样品中Ca2+的浓度]抽取血样40.00mL,经过上述处理后得到草酸,再用0.020molL-1KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗24.00mLKMnO4溶液。
(4)请书写草酸与KMnO4溶液反应的离子方程式:___。
(5)经过计算,血液样品中Ca2+的浓度为___mgcm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com