
科目: 来源: 题型:
【题目】下列叙述中,正确的一组是( )
![]() 糖类、油脂、蛋白质在一定条件下都能发生水解
糖类、油脂、蛋白质在一定条件下都能发生水解
![]() 除去乙酸乙酯中残留的乙酸,可加过量饱和Na2CO3溶液振荡后,静置分液
除去乙酸乙酯中残留的乙酸,可加过量饱和Na2CO3溶液振荡后,静置分液
![]() 石油的分馏、裂化和煤的干馏都是化学变化
石油的分馏、裂化和煤的干馏都是化学变化
![]() 检验溴乙烷中溴原子的方法是将溴乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液
检验溴乙烷中溴原子的方法是将溴乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液
![]() 淀粉遇碘酒变蓝色,葡萄糖能与新制Cu(OH)2发生反应
淀粉遇碘酒变蓝色,葡萄糖能与新制Cu(OH)2发生反应
![]() 塑料、橡胶和纤维素都是合成高分子材料
塑料、橡胶和纤维素都是合成高分子材料
![]() 向蛋白质溶液中加入饱和Na2SO4溶液,出现盐析现象,加水溶解
向蛋白质溶液中加入饱和Na2SO4溶液,出现盐析现象,加水溶解
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,利用 CO2 合成 CH3OH 的反应如下:CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g)△H1,研究发现,反应过程中会有副反应:CO2(g) + H2(g)
CH3OH(g) + H2O(g)△H1,研究发现,反应过程中会有副反应:CO2(g) + H2(g)![]() CO(g) + H2O(g) △H2。温度对 CH3OH、CO 的产率影响如图所示。下列说法中,不正确的是
CO(g) + H2O(g) △H2。温度对 CH3OH、CO 的产率影响如图所示。下列说法中,不正确的是
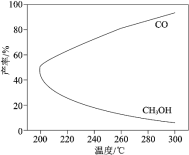
A.△H1 < 0,△H2 > 0
B.增大压强可以缩短合成反应达到平衡所需的时间
C.生产过程中,温度越高越有利于提高 CH3OH 的产率
D.合成 CH3OH 反应的平衡常数表达式是K=![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-115.6kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
2Cl2(g)+2H2O(g) ΔH=-115.6kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
A.气体的质量不再改变
B.氯化氢的转化率不再改变
C.断开4molH—Cl键的同时生成4molH—O键
D.n(HCl)∶n(O2)∶n(Cl2)∶n(H2O)=4∶1∶2∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:

下列说法正确的是
A.打浆步骤,将电石渣配制成溶液
B.氯化步骤,发生的主要反应2Ca(OH)2 + 2Cl2 = Ca(ClO)2 + CaCl2 +2H2O
C.氯化过程加快氯气的通入速率,有利于提高KClO3的产率
D.KClO3晶体中可能混有 KCl、KClO等杂质
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机化工原料的结构简式如图所示,下列关于该有机物的说法正确的是( )
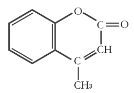
A.1 mol该物质最多能和5mol H2发生加成反应
B.能使酸性KMnO4溶液褪色,能发生加成反应和取代反应
C.该分子中所有原子都可能共平面
D.该物质的分子式为C10H10O2
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图所示装置探究Cl2和NO2在NaOH溶液中的反应,若通入适当比例的Cl2和NO2,即发生反应Cl2+2NO2+4NaOH=2NaNO3+2NaCl+2H2O。
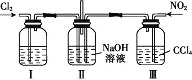
下列叙述正确的是
A. 实验室中用二氧化锰与3 mol·L-1的盐酸共热制备氯气
B. 装置Ⅰ中盛放的试剂是浓硫酸,作用是干燥氯气
C. 装置Ⅲ的作用是便于控制通入NO2的量
D. 若制备的NO2中含有NO,应将混合气体通入水中以除去NO
查看答案和解析>>
科目: 来源: 题型:
【题目】据报道,我国科学家研制出以石墨烯为载体的催化剂,在 25℃下用 H2O2 直接将 CH4转化为含氧有机物,其主要原理如下图所示:
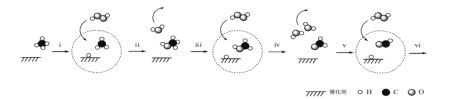
下列说法不正确的是
A.上图中 ![]() 代表 H2O2
代表 H2O2
B.由上图可知,步骤 iv 生成的 H2O,其中的 H 原子全部来自 H2O2
C.步骤 i、ii 的总反应方程式是CH4+H2O2![]() CH3OH+H2O
CH3OH+H2O
D.根据以上原理,推测步骤 vi 生成 HCOOH 和 H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,装置如下图所示。
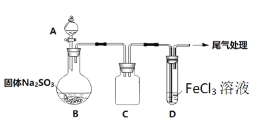
已知:
i.Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。
ii.生成Fe(HSO3)2+离子的反应为:Fe3+ +HSO![]() Fe(HSO3)2+ 。
Fe(HSO3)2+ 。
步骤一:实验准备:
如上图连接装置,并配制100mL 1.0 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管D 中。
(1)配制100mL1.0 mol·L-1 FeCl3溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和______,装置C的作用为:________________。
(2)用离子方程式解释1.0 mol·L-1 FeCl3溶液(未用盐酸酸化)pH=1的原因:________
步骤二:预测实验
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色。
该小组同学预测的理论依据为:________________
步骤三:动手实验
(4)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,将混合液放置12小时,溶液才变成浅绿色。
①SO2与FeCl3溶液反应生成了Fe(HSO3)2+离子的实验证据为:__________。证明浅绿色溶液中含有Fe2+的实验操作为:_____________ 。
②为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验。
实验I | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
实验II | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
综合上述实验探究过程,得出的结论为:____________。
步骤四:反思实验:
(5)在制备SO2的过程中,同学们发现,使用70%的硫酸比用98%的浓硫酸反应速率快,分析其中的原因是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是五种短周期元素的原子序数与其在氢化物中化合价的关系图,则下列说法不正确的是( )
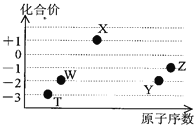
A.X的氢化物具有很强的还原性
B.YW2、ZW2、X2W2都能使品红溶液褪色,且褪色原理相同
C.Y、Z元素的最高价氧化物对应的水化物都呈酸性,而且酸性:HZO4 > H2YO4
D.元素W、T的氢化物的沸点比同主族中相邻的氢化物高,是因为这两种氢化物分子间存在氢键
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸盐在能源、环保等方面有着广泛的用途,在生产和生活中有广泛的应用。
已知:i.高铁酸钠(Na2FeO4)极易溶解于水,20℃溶解度为111克;高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。
ii.高铁酸钾(K2FeO4)在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。
iii.高铁酸根在水溶液中存在平衡:![]()
![]() ↑
↑
(1)工业上用氯气和烧碱溶液可以制取次氯酸钠,反应的离子方程式为___________。
(2)高铁酸钾是一种理想的水处理剂,既可以对水杀菌消毒,又可以净化水,其原理为________。
(3)工业上有多种方法制备高铁酸钾。
方法1:次氯酸盐氧化法。工艺流程如图所示。
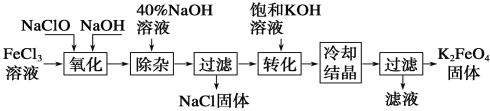
①“氧化”过程中的氧化剂为(填化学式)______________。
②写出“转化”过程中的化学方程式为__________________。
③上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是将粗产品先用稀KOH溶液溶解,然后再加入饱和KOH溶液,冷却结晶过滤。上述操作中溶解粗产品用稀KOH溶液,不用蒸馏水,根据平衡移动原理解释__________。
(4)方法2:电解法
我国化学工作者还提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如下图所示。
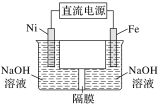
①Ni电极作________(填“阴”或“阳”)极;
②Fe电极的电极反应式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com