
科目: 来源: 题型:
【题目】常温下,量取pH=2的两种二元酸H2A与H2B各1ml,分别加水稀释,测得pH与加水稀释倍数有如图所示关系,则下列有关叙述不正确的是

A. H2B为弱酸
B. NaHA水溶液中:c(Na+)+c(H+)=2c(A2-)+c(OH-)
C. 含等物质的量的NaHA、NaHB的混合溶液中:c(Na+)=c(A2-)+c(HB-)+c(B2-)+c(H2B)
D. pH=10的NaHB溶液中:c(Na+)>c(HB-)>c(B2-)>c(OH-)>c(H2B)
查看答案和解析>>
科目: 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是高中化学常见的氧化剂,工业上以铬铁矿为原料用碱溶氧化法制备。铬铁矿中通常含有Cr2O3、FeO、Al2O3、SiO2等。

已知:①NaFeO2遇水强烈水解②2CrO42-(黄色) + 2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
请回答下列问题:
(1)将矿石粉碎的目的是________;高温灼烧时Cr2O3发生反应的化学方程式为__________。
(2)滤渣1中有红褐色物质,写出生成该物质反应的离子方程式________。滤渣2的主要成分是A1(OH)3和______________。
(3)用简要的文字说明Na2Cr2O7溶液中加入KC1固体,降温析出K2Cr2O7的原因_______。
(4)25°C时,对反应2CrO42-(黄色)+2H+![]() Cr2O72- (橙色)+H2O,取Na2CrO4溶液进行实验,测得部分实验数据如下:
Cr2O72- (橙色)+H2O,取Na2CrO4溶液进行实验,测得部分实验数据如下:
时间/ (S) | 0 | 0.01 | 0.02 | 003 | 0.04 |
(CrO42-)/ (mol·L-1) | 0.20 | 1.6×10-2 | 1.2×10-2 | 1.0×10-2 | |
(Cr2O72-)/ (mol·L-1) | 0 | 9.2×l0-2 | 9.4×10-2 | 9.5×10-2 |
反应达到平衡时,溶液的pH=l,该反应平衡常数K为______。
②下列有关说法正确的_____________。
a.加少量NaHCO3固体,可使溶液的橙色加深
b.0.03 s时v(CrO42-)(正)=2v(Cr2O72-)(逆)
c.溶液中c(CrO42-):c(Cr2O72-)=2 : 1时该反应己达平衡状态
d.反应达到平衡时CrO42-的转化率为95%
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,浓度均为 0.1 mol/L 的溶液,其 pH 如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.①和③中阴离子的总浓度:c(Cl-) + c(OH-)>c(F-) + c(OH-)
D.④中:c(![]() ) + 2c(
) + 2c(![]() ) + c(H2CO3) 0.1 mol/L
) + c(H2CO3) 0.1 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
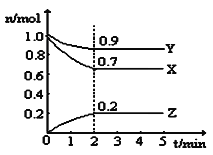
(1)该反应的化学方程式为______。
(2)反应开始至2min,以气体Z表示的平均反应速率为______。平衡时X的转化率为______。
(3)2min反应达到平衡,容器内混合气体的平均相对分子质量比起始时______![]() 填“大”、“小”或“相等”,下同
填“大”、“小”或“相等”,下同![]() ,混合气体密度比起始时______。
,混合气体密度比起始时______。
(4)下列叙述能证明该反应已经达到化学平衡状态的是![]() 填序号
填序号![]() ______。
______。
A.Y的体积分数不再变化 B.容器内气体压强不再变化
C.υ(X) :υ(Y) =3:1 D.单位时间内消耗3nmol X同时生成2nmol Z
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)2NH3(g) △H=-92.4kJmol-1
一种工业合成氨的简易流程图如图:
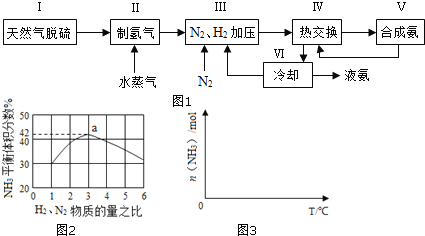
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___。
(2)步骤II中制氯气原理如下:
①CH4(g)+H2O(g)=CO2(g)+3H2(g) △H=+206.4kJmol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJmol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是___。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为___。
(3)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:___。
(4)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图___。
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是___(填序号),简述本流程中提高合成氨原料总转化率的方法:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化氢和臭氧是用途很广的氧化剂。试回答下列问题:
(1)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式:____________________________________
(2)Na2O2、K2O2、 以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是____________(写电子式),
臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,反应的化学方程式为:
KI+O3+H2O→KOH+I2+O2(未配平 ) 回答问题:
① 还原产物的化学式为_____________
② 配平后的化学方程式是________________________________
(4)O3 可由臭氧发生器(原理如下图所示)电解稀硫酸制得。

①图中阴极为_____(填“A”或“B”)。
② 若C处不通入O 2 ,D、E处分别收集到11.2L和有4.48L
气体(标准状况下), 则E处收集的气体中O3所占的体积分数
为__________(忽略 O 3 的分解)。
③ 若C处通入O 2,则A极的电极反应式为:____________。
(5)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+ O3(g)![]() NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是___________
NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是___________

a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.反应物的总能量低于生成物的总能量
d.Δt1=Δt2时,NO的转化率:a~b段小于b~c段
查看答案和解析>>
科目: 来源: 题型:
【题目】目前海水提溴的最主要方法之一是空气吹出法,其部分流程图如下:
![]()
以下推断不合理的是( )
A. 热空气能吹出溴是利用溴易挥发的性质
B. SO2吸收溴的反应方程式:SO2+2H2O+Br2=H2SO4+2HBr
C. 流程中循环利用的物质有SO2、Br2、Cl2等
D. 没有采用直接蒸馏含Br2的海水得到单质溴主要是为了节能
查看答案和解析>>
科目: 来源: 题型:
【题目】在 100℃时,将 0.40 mol NO2 气体充入 2 L 的密闭容器中,发生如下反应:2NO2(g)![]() N2O4(g) H < 0。监测反应获得如下数据:
N2O4(g) H < 0。监测反应获得如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
下列说法正确的是
A.0~20 s 内,v(NO2) = 0.005 mol·L-1.s-1
B.若上述反应在 120℃时进行,则反应至 80 s 时,n(N2O4) < 0.08 mol
C.若仅将起始时充入 NO2 的量增至 0.80 mol,达平衡时 NO2 转化率将减少
D.59 s 时,c(NO2)一定大于 0.12 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示;下列描述错误的是:

A. 淡化海水的方法主要有蒸馏法、电渗析法、离子交换法
B. 以NaCl为原料可以生产烧碱、纯碱、金属钠、氯气、盐酸等化工产品
C. 步骤Ⅱ中鼓入热空气吹出溴,是因为溴蒸气的密度比空气的密度小
D. 用SO2水溶液吸收Br2的离子反应方程式为:Br2+SO2+2H2O═4H++SO42﹣+2Br﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车发动机中生成 NO 的反应为:N2(g) + O2(g)![]() 2NO(g),t℃时,K= 0.09。在 t℃下甲、乙、丙三个恒容密闭容器中,投入 N2(g)和 O2(g)模拟反应,起始浓度如下表所示。
2NO(g),t℃时,K= 0.09。在 t℃下甲、乙、丙三个恒容密闭容器中,投入 N2(g)和 O2(g)模拟反应,起始浓度如下表所示。
起始浓度 | 甲 | 乙 | 丙 |
c(N2)/mol·L-1 | 0.46 | 0.46 | 0.92 |
c(O2)/mol·L-1 | 0.46 | 0.23 | 0.92 |
下列判断不正确的是
A.起始时,反应速率:丙>甲>乙B.平衡时,N2 的转化率:甲>乙
C.平衡时,c(NO):甲=丙>乙D.平衡时,甲中 c(N2)= 0.4mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com