
科目: 来源: 题型:
【题目】A是相对分子质量为28的烃。以A为原料合成有机化合物D的方法如下图所示。

(1)A 的结构简式是_____________,A → B 的反应类型是_____________。
(2)B→C 反应的试剂及条件是_________________。
(3)C→D 反应的化学方程式是________________。
(4)写出C 和乙二酸在一定条件下合成高分子化合物的化学方程式:_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中,反应X2(g)+Y2(g)2XY(g)△H>0,达到甲平衡.在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是
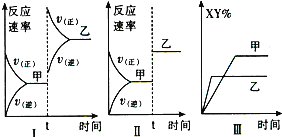
A. 图I是升高温度的变化情况
B. 图Ⅱ是扩大容器体积的变化情况
C. 图Ⅲ是增大压强的变化情况
D. 图Ⅲ是升高温度的变化情况
查看答案和解析>>
科目: 来源: 题型:
【题目】用惰性电极电解物质的量浓度相同、体积比为1∶3的 CuSO4和 NaCl的混合溶液,可能发生的反应有( )
①2Cu2++2H2O![]() 2Cu+4H++O2↑
2Cu+4H++O2↑
②Cu2++2Cl-![]() Cu+Cl2↑
Cu+Cl2↑
③2Cl-+2H+![]() H2↑+Cl2↑
H2↑+Cl2↑
④2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
A. ①②③B. ①②④C. ②③④D. ②④
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用如图所示的装置制备乙酸乙酯,回答下列相关问题:

(1)连接好装置后,在加入试剂之前需要进行的操作是_________________________。
(2)甲试管中需加入少量____________以防止暴沸。
(3)浓硫酸在反应中的作用是________________________________。
(4)甲试管中发生反应的化学方程式为_______________________________。
(5)乙中导管没有伸入到液面下,原因是________________________________________。
(6)上述实验中饱和碳酸钠溶液的作用是___________(填序号)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的溶解度小,有利于分层析出
(7)欲将乙中的物质分离得到乙酸乙酯,采取的实验方法是___________;分离时,乙酸乙酯应该从仪器的__________________(填“下口放出”或“上口倒出”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】富铁铝土矿![]() 主要含有
主要含有![]() 、
、![]() 、FeO和
、FeO和![]() 可制备新型净水剂液体聚合硫酸铝铁
可制备新型净水剂液体聚合硫酸铝铁![]() 研究发现,当
研究发现,当![]() 时净水效果最好.工艺流程如下
时净水效果最好.工艺流程如下![]() 部分操作和产物略
部分操作和产物略![]() :
:
![]()
![]() 与
与![]() 发生反应的离子方程式是 ______ .
发生反应的离子方程式是 ______ .
![]() 测得滤液中
测得滤液中 加入
加入![]() 和
和![]() 的作用是
的作用是![]() 结合化学用语说明
结合化学用语说明![]() ______ .
______ .
![]() 将溶液A电解得到液体聚合硫酸铝铁.装置如图所示
将溶液A电解得到液体聚合硫酸铝铁.装置如图所示![]() 阴离子交换膜只允许阴离子通过,电极为惰性电极
阴离子交换膜只允许阴离子通过,电极为惰性电极![]()

![]() 阴极室的电极反应式是 ______ .
阴极室的电极反应式是 ______ .
![]() 电解过程阳极室溶液pH的变化是 ______
电解过程阳极室溶液pH的变化是 ______ ![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() .
.
![]() 简述在反应室中生成液体聚合硫酸铝铁的原理 ______ .
简述在反应室中生成液体聚合硫酸铝铁的原理 ______ .
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来,我国多地频现种种极端天气,二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素.
![]() 活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入
活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入![]() NO和
NO和![]() 固体活性炭
固体活性炭![]() 无杂质
无杂质![]() ,生成气体E和气体
,生成气体E和气体![]() 当温度分别在
当温度分别在![]() 和
和![]() 时,测得平衡时各物质的物质的量如下表:
时,测得平衡时各物质的物质的量如下表:
| 活性炭 | NO | E | F |
|
|
|
|
|
|
|
|
|
|
![]() 结合上表数据,写出NO与活性炭反应的化学方程式 ______ ;
结合上表数据,写出NO与活性炭反应的化学方程式 ______ ;
![]() 上述反应的平衡常数表达式
上述反应的平衡常数表达式![]() ______ ,根据上述信息判断,
______ ,根据上述信息判断,![]() 和
和![]() 的关系是 ______ ;
的关系是 ______ ;
A.![]() B.
B.![]() C.无法比较
C.无法比较
![]() 在
在![]() 下反应达到平衡后,下列措施能改变NO的转化率的是 ______ ;
下反应达到平衡后,下列措施能改变NO的转化率的是 ______ ;
![]() 增大
增大![]()
![]() 增大压强
增大压强![]() 升高温度
升高温度![]() 移去部分F
移去部分F
![]() 碘循环工艺不仅能吸收
碘循环工艺不仅能吸收![]() 降低环境污染,同时又能制得
降低环境污染,同时又能制得![]() ,具体流程如图所示
,具体流程如图所示

![]() 用离子方程式表示反应器中发生的反应 ______ ;
用离子方程式表示反应器中发生的反应 ______ ;
![]() 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出
用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出![]() 的目的是 ______ ;
的目的是 ______ ;
![]() 开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池
开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池![]() 简称
简称![]() 由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图所示
由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图所示

通过a气体的电极是原电池的 ______ 极![]() 填“正”或“负”
填“正”或“负”![]() ,b电极反应式为 ______ .
,b电极反应式为 ______ .
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学研究性学习小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备![]() 已知某化工厂的含镍催化剂主要含有Ni,还含有
已知某化工厂的含镍催化剂主要含有Ni,还含有![]() 、
、![]() 的单质及氧化物,其他不溶杂质
的单质及氧化物,其他不溶杂质![]() 。
。

部分阳离子以氢氧化物形式沉淀时的pH如表所示:
沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
|
|
|
|
|
|
|
|
|
|
|
|
![]() 加入
加入![]() 时发生反应的离子方程式______。
时发生反应的离子方程式______。
![]() 操作b为调节溶液的pH,你认为pH的调控范围是______。
操作b为调节溶液的pH,你认为pH的调控范围是______。
![]() 产品晶体中混有少量绿矾
产品晶体中混有少量绿矾![]() ,其原因可能是______
,其原因可能是______![]() 写出一点即可
写出一点即可![]() 。为了测定产品的纯度,某同学称取50克该产品晶体配成100mL溶液,取20mL该溶液于锥形瓶中,然后用
。为了测定产品的纯度,某同学称取50克该产品晶体配成100mL溶液,取20mL该溶液于锥形瓶中,然后用![]() 的酸性
的酸性![]() 标准液滴定,直到______为止,重复以上操作两次,消耗酸性
标准液滴定,直到______为止,重复以上操作两次,消耗酸性![]() 溶液体积的平均值为
溶液体积的平均值为![]() 不被氧化
不被氧化![]() ,则该产品晶体的纯度是______。
,则该产品晶体的纯度是______。![]() 结果保留3位有效数字
结果保留3位有效数字![]() 的摩尔质量为
的摩尔质量为![]()
![]() 可用于制备镍氢电池
可用于制备镍氢电池![]() ,NiMH中的M表示储氢金属或合金。该电池在充电过程中总反应的化学方程式是
,NiMH中的M表示储氢金属或合金。该电池在充电过程中总反应的化学方程式是![]() ,则NiMH电池放电过程中正极的电极反应式为______。
,则NiMH电池放电过程中正极的电极反应式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去):

(1)若A、B、C、D均是10电子粒子,请写出A、D的化学式:A___;D___。
(2)若A和C均是18电子粒子,且A为阴离子,B和D均是10电子粒子,则A与B在溶液中反应的离子方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中,反应X2(g)+Y2(g)2XY(g) △H<0达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
A. 图Ⅰ是加入反应物的变化情况
图Ⅰ是加入反应物的变化情况
B. 图Ⅱ是扩大容器体积的变化情况
图Ⅱ是扩大容器体积的变化情况
C. 图Ⅲ是增大压强的变化情况
图Ⅲ是增大压强的变化情况
D. 图Ⅲ是升高温度的变化情况
图Ⅲ是升高温度的变化情况
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com