
【题目】已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去):

(1)若A、B、C、D均是10电子粒子,请写出A、D的化学式:A___;D___。
(2)若A和C均是18电子粒子,且A为阴离子,B和D均是10电子粒子,则A与B在溶液中反应的离子方程式为___。
科目:高中化学 来源: 题型:
【题目】实验室常用亚硫酸钠固体和70%的浓硫酸制备SO2气体,反应方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,请设计一套实验装置,收集一试管干燥的SO2气体。
(1)在下面方框中,A表示由分液漏斗和锥形瓶组成的气体发生器,请在答题卡上的A后完成该反应的实验装置示意图(夹持装置、连接胶管不必画出,尾气处理部分必须画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C…;其它可选用的仪器(数量不限)简易表示如下:___
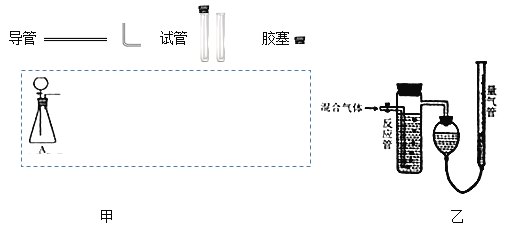
(2)根据方框中的装置图甲,在答题卡上填写下表(可不填满)___
仪器标号 | 仪器中所加物质 | 作用 |
A | 亚硫酸钠、浓硫酸 | 产生SO2 |
(3)某实验小组用如图乙装置测定收集到的气体中SO2的含量,反应管中装有酸性高猛酸钾溶液。
①SO2和酸性高猛酸钾溶液发生反应的离子方程式为:___。
②反应管内溶液紫红色消失后,若没有及时停止通气,则测得的SO2含量___(选填:“偏高”、“偏低”或“无影响”)
③若酸性高猛酸钾溶液体积为V1mL,浓度为cmol/L,量气管内增加的水的体积为V2mL(已折算成标准状况下的体积)。用c、V1、V2表示SO2的体积百分含量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿烧渣(主要成分为Fe2O3及少量的FeS、SiO2、Cu、Au、Ag等)为原料制备颜料铁红(Fe2O3)、晶体E,回收H和重金属混合物的生产工艺流程如图所示:

请按要求回答下列问题:
(1)工艺流程的中间产物(NH4)2Fe6(SO4)4(OH)12中Fe的化合价为__。Fe在周期表中的位置为第___周期第VIII族。
(2)将烧渣溶解前需进行“粉碎和提高温度”的目的是___。过程①溶解烧渣所需试剂中溶质的化学式为___。反应②的化学方程式:___。
(3)反应③的目的是___。气体Z的电子式:___。写出反应④的离子方程式:__。
(4)将回收的H溶于少量水,所得溶液中所有离子的浓度由大到小依次是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )

A. 溶液中一定不含CO32﹣,可能含有SO42-和NO3-
B. 溶液中n(NH4+)="0.2" mol
C. 溶液中的阳离子只有H+、Mg2+、Al3+
D. n(H+)︰n(Al3+)︰n(Mg2+)=1︰1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示的装置制备乙酸乙酯,回答下列相关问题:

(1)连接好装置后,在加入试剂之前需要进行的操作是_________________________。
(2)甲试管中需加入少量____________以防止暴沸。
(3)浓硫酸在反应中的作用是________________________________。
(4)甲试管中发生反应的化学方程式为_______________________________。
(5)乙中导管没有伸入到液面下,原因是________________________________________。
(6)上述实验中饱和碳酸钠溶液的作用是___________(填序号)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的溶解度小,有利于分层析出
(7)欲将乙中的物质分离得到乙酸乙酯,采取的实验方法是___________;分离时,乙酸乙酯应该从仪器的__________________(填“下口放出”或“上口倒出”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】7000C时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1)
CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1)
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法中正确的是
A.反应在t1min内的平均速率为υ(CO2)=![]() mol·L-1·min-1
mol·L-1·min-1
B.到t1min时,反应未达平衡状态
C.保持7000C不变,向平衡体系中再通入0.60molCO和0.30 molH2O,达到新平衡时与原平衡相比,CO转化率增大,H2的体积分数增大
D.温度升至8000C时,上述反应的平衡常数为0.64,则正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中正确的是
A. l00g 9%的葡萄糖水溶液中氧原子数为0.3 NA
B. 标准状况下,2.24L F2通入足量饱和食盐水中可置换出0.1NA个Cl2
C. 工业合成氨每断裂NA个N≡N键,同时断裂6NA个N-H键,则反应达到平衡
D. 常温下l LpH=7的1mol/LCH3COONH4溶液中CH3COO-与NH4+数目均为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际计量大会第26次会议新修订了阿伏加德罗常数(Na = 6. 022214076×l023mol-1),并于2019年5月20日正式生效。下列说法不正确的是
A. 标准状况下11. 2 L的CH3Cl中含有氢原子的数目为1. 5NA
B. lmol Na2O2固体中含有阴、阳离子的总数目为3NA
C. l00mL lmolL-1 NH4Cl溶液中含有阳离子的数目大于0.1 NA
D. 18gD2O和H2O的混合物中含有的中子数为9NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com