
科目: 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=1的溶液中:Na+、K+、![]() 、
、![]()
B.c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、![]() 、
、![]()
C.0.1mol/LNH4HCO3溶液中:K+、Na+、![]() 、Cl-
、Cl-
D.0.1mol/LFeCl3溶液中:Na+、![]() 、S2-、
、S2-、![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.Cu与过量稀硝酸在加热时的反应:3Cu+2NO3﹣+8H+![]() 3Cu2++2NO↑+4H2O
3Cu2++2NO↑+4H2O
B.将氯气溶于水配置氯水:Cl2+H2O![]() 2H++Cl﹣+ClO﹣
2H++Cl﹣+ClO﹣
C.铁与FeCl3溶液反应:2Fe+Fe3+═3Fe2+
D.向Ca(ClO)2溶液中通入足量CO2:Ca2++CO2+H2O═CaCO3↓+2H+
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:

已知:①菱锰矿石主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素;
②常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11
③相关金属离子c(Mn+)=0.1mol/L形成氯氧化物沉淀时的pH如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
回答下列问题:
(1)“焙烧”时发生的主要化学反应方程式为______________________。
(2)分析下列图1、图2,氯化铵焙烧菱镁矿的最佳条件是:焙烧温度_________,氯化铵与菱镁矿粉的质量之比为_________。
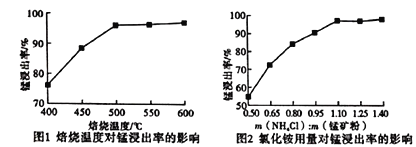
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式______;然后调节溶液pH使Fe3+、Al3+沉淀完全,此时溶液的pH范围为_________。再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10-5mol/L时,c(Mg2+)=______mol/L
(4)碳化结晶时,发生反应的离子方程式为____________________________。
(5)流程中能循环利用的固态物质是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 标准状况下,11.2L14CO2含有的中子数为11NA
B. 5.6gFe粉与足量S粉加热充分反应转移的电子数为0.2NA,
C. 1molNa2O2固体中所含离子数目为4NA
D. 1LpH=6的纯水中含有OHˉ的数目为10-8NA
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A+3B=2C+D在四种不同情况下的反应速率分别为:
①v(A) =0.15mol/(L·s) ②v(B)=0.6mol/(L·s) ③v(C)=0.5mol/(L·s) ④v (D) =0.45mol/(L·s),则反应进行由快到慢的顺序为:
A.④>③>①>②B.②>④>③>①
C.②>③>④>①D.④>③>②>①
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法不正确的是
A.4.6gNa 与含 0.1molHCl 的稀盐酸充分反应,转移电子数目为 0.2 NA
B.质量为 3.0g 的 15N2 和 C18O 混合物中含有中子数为 1.6NA
C.常温常压下,1.12L 的 CO2 和 SO2 混合气体中,含有氧原子的数目小于 0.1NA
D.在 1L相同浓度的硫酸钾和硫酸铁混合液中K+浓度为 0.2 mol·Lˉ1,则溶液中 SO42—的数目为0.3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3![]() 2HNO3+4N2↑+9H2O反应,生成28gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应,生成28gN2时,转移的电子数目为3.75NA
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是重要的化工原料,利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇时,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1= -99kJmol-1
CH3OH(g) △H1= -99kJmol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2= 58kJmol-1
CH3OH(g)+H2O(g) △H2= 58kJmol-1
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=+41kJmol-1
CO(g)+H2O(g) △H3=+41kJmol-1
(1)一定温度下,向体积为2L的密闭容器中加入CO和H2,假设只发生反应①,达平衡后测得各组分浓度如下:
物质 | CO | H2 | CH3OH |
浓度(molL-1) | 0.9 | 1.0 | 0.6 |
①列式并计算平衡常数K=___。
②若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是___。
③若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正__v逆(填“>”、“<”或“=”)。
(2)在实际生产中,当合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率α(CO)与温度和压强的关系如图所示。
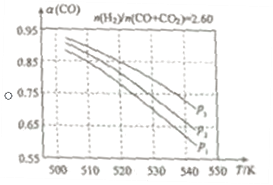
α(CO)值随温度升高而___(填“增大”或“减小”),其原因是___。图中的压强由大到小为___,其判断理由是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用10 mol/L的浓盐酸配制250mL 1 mol/L的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸______mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有_____、_____等。
(3)取所配制的稀盐酸100mL,与一定质量的锌充分反应,锌全部溶解后,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为_____g 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com