
科目: 来源: 题型:
【题目】下列说法正确的是
A. 氢氧燃料电池放电时化学能全部转化为电能
B. 反应4Fe(s)+3O2(g)![]() 2Fe2O3(s)常温下可自发进行,该反应为吸热反应
2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C. 3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
D. 在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于苯的叙述正确的是
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的结构简式 看,苯分子中含有碳碳双键,应属于烯烃
看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的化学键完全相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 电解饱和MgCl2溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B. 向酸性KMnO4溶液中通入SO2:3SO2+2MnO4-+4OH-===2MnO2↓+3SO42-+2H2O
C. 向Fe(NO3)2稀溶液中滴加足量氢碘酸:3Fe2++NO3-+4H+===3Fe3++NO↑+2H2O
D. 向NaClO溶液中通入足量CO2:ClO-+CO2+H2O===HClO+HCO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是( )
A.常温常压下,11.2 L SO2含有的氧原子数小于NA
B.0. 1 mol Na2O2和Na2O的混合物中含有的离子总数等于0.4NA
C.10 g质量分数为34%的H2O2溶液含有的氢原子数为0.2NA
D.100 mL 0.1 mol/L醋酸中含有的醋酸分子数是0.01NA
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如下图所示,下列说法不正确的是
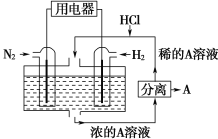
A. 通入N2的电极发生的电极反应式为:N2+6e-+8H+=2NH4+
B. 反应过程中溶液的pH会变大,故需要加入盐酸
C. 该电池外电路电流从通入H2的电极流向通入N2的电极
D. 通入H2的电极为负极,A为NH4Cl
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,向一个压强不变的容器中,通入![]() 和
和![]() 及固体催化剂,使之反应:
及固体催化剂,使之反应:![]() ,平衡时容器内气体总的物质的量为起始时的
,平衡时容器内气体总的物质的量为起始时的![]() 。保持同一反应温度,在相同容器中,将起始物质的量改为
。保持同一反应温度,在相同容器中,将起始物质的量改为![]() 、
、![]() 、
、![]() ,下列说法正确的是
,下列说法正确的是
A.第一次平衡时反应放出的热量为![]()
B.第二次平衡![]() 的转化率为
的转化率为![]()
C.第二次达平衡时![]() 的体积分数大于
的体积分数大于![]()
D.达平衡时用![]() 表示的反应速率为
表示的反应速率为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】以镍黄铁矿为原料制备![]() 的工艺流程如下:
的工艺流程如下:
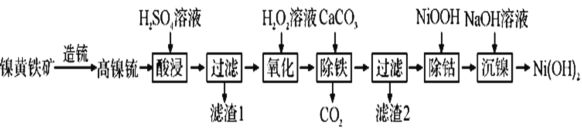
已知:①高镍锍的主要成分为![]() 、
、![]() 、
、![]() 、
、![]() 的低价硫化物及合金;
的低价硫化物及合金;
②氧化性:![]() ;
;
③![]() ,
, ![]() ,
,![]() 。
。
回答下列问题:
(1)“酸浸”时,H2SO4溶液需过量,其目的是________。
(2)“过滤”时滤渣1的主要成分是________。
(3)“氧化”时反应的化学方程式为_________,若用NaClO代替H2O2溶液,使0.2molFe2+转化为Fe3+,则需NaClO至少为___mol。
(4)“除铁”的原理是_________。
(5)“除钴”时,发生反应的离子方程式为____________。
(6)“沉镍”后需过滤、洗涤,证明沉淀已洗涤干净的方法是_____。若“沉镍”后的滤液中![]() ,则滤液的pH>____
,则滤液的pH>____
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol/L的稀盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为________mL的容量瓶。
(2)经计算需要________mL浓盐酸,在量取时宜选用________量筒。
A.5 mL B.10 mL C.25 mL D.50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面距容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅拌,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)________。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度会______(填“偏高”“偏低”或“无影响”)。若未用蒸馏水洗涤烧杯内壁和玻璃棒或未将洗涤液注入容量瓶,则配制的稀盐酸浓度会________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)基态Fe原子有______个未成对电子,Fe3+的电子排布式为______。可用硫氰化钾检验Fe3+,形成的配合物的颜色为______。
(2)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。1mol乙醛分子中含有的键的数目为______。乙醛中碳原子的杂化轨道类型为______,乙酸的沸点明显高于乙醛,其主要原因是______。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______个铜原子。
(3)Al单质为面心立方晶体,其晶胞边长a0.405nm,晶胞中铝原子的配位数为______。列式表示Al单质的密度______ gcm-3。(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O![]() +O2+4OH-=Fe3O4↓+S4O
+O2+4OH-=Fe3O4↓+S4O![]() +2H2O。
+2H2O。
①参加反应的氧化剂与还原剂的物质的量之比为______。
②若有2molFe2+被氧化,则被Fe2+还原的O2的物质的量为______mol。
③每生成1molFe3O4,反应转移的电子为______mol。
(2)往含Fe3+、H+、NO![]() 的混合液中加入少量SO
的混合液中加入少量SO![]() ,反应的离子方程式为______。
,反应的离子方程式为______。
(3)向CuSO4溶液中逐滴加入KI溶液至过量,观察到有沉淀(CuI)生成,且溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。写出此过程涉及的离子方程式______,______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com