
科目: 来源: 题型:
【题目】图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
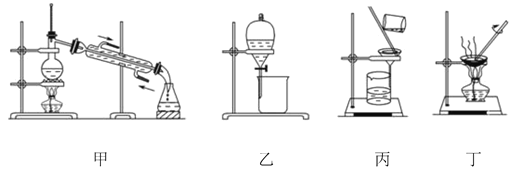
(1)为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

a.灼烧海带时,除需要三脚架、泥三角外,还需要用到实验仪器是_____(填字母)。
A.烧杯 B.坩埚 C.表面皿 D.酒精灯 E. 干燥器
b.步骤③的实验选择上述图_____(填“甲”“乙”或“丙”)装置。步骤⑤的实验操作名称是_____。步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是_____,选择上述图_____(填“甲”“乙”或“丙”)装置。
(2)某盐的混合溶液中含有Na+、Mg2+、Cl-、SO42-离子,测得Na+、Mg2+ 和Cl-的物质的量浓度依次为0.2molL-1、0.25molL-1、0.4molL-1,则c(SO42-)=_____
查看答案和解析>>
科目: 来源: 题型:
【题目】对羟基苯甲酸乙酯广泛用于食品、化妆品、医药等领域。某化学兴趣小组通过查阅文献,制备羟基苯甲酸乙酯。回答下列问题:
(一)对羟基苯甲酸乙酯的合成
实验原理: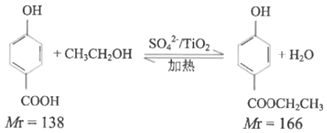
实验步骤:取0.4mol乙醇和催化剂置于干燥的仪器A中,0.1mol对羟基苯甲酸置于恒压滴液漏斗C中,实验装置如图所示(加热和夹持装置省略)。加热回流,充分反应。
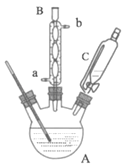
(1)仪器A的名称是_____。仪器B中冷凝水的流向为从_____(“a”或“b”)通入。
(2)某同学准备在仪器A和球形冷凝管之间加一个脱水装置,用化学平衡原理解释这样做的优点是_____。
(3)取催化剂2g,对羟基苯甲酸0.1mol,乙醇0.4mol,反应过程中酯的产率与反应时间的关系如下表所示:
反应时间/小时 | 1 | 3 | 4 | 5 | 6 |
酯的产率/% | 45.6 | 88 | 91.8 | 91.1 | 90.8 |
根据表中数据可知,最佳反应的时间应为_____;反应时间过长,产率有所下降的可能原因是_____。
(二)对羟基苯甲酸乙酯的精制
实验方法:①反应完毕后趁热滤出催化剂,滤液倒入冷水中,析出固体,过滤。
②固体先后用5%的Na2CO3溶液和水洗涤,干燥后得到粗产品。
③在装有冷凝管的圆底烧瓶中,按照一定比例加入粗品酯、乙醇、水和活性炭,加热回流0.5小时,趁热抽滤,滤液冷却,析出白色晶体,于80℃烘干。
(4)在②中用5%的Na2CO3溶液洗涤的目的是_____,能不能用NaOH溶液替代?_____(填“能”或“不能”)。
(5)在③趁热抽滤主要除去的杂质为_____,“趁热”的目的是_____。
(6)该小组同学按(3)中数据投料,最后得到对羟基苯甲酸乙酯14.9g,则该实验的产率为_____%。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片(锌片和铜片不接触),可观察到铜片上________(填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(见图A),组成一个原电池,负极为________,正极的电极反应式为________________________。
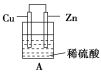
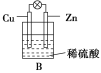
(2)如果烧杯中最初装入的是2 mol/L 500 mL的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失),当在标准状况下收集到11.2 L的氢气时,则此时烧杯内溶液中硫酸的物质的量浓度为(溶液体积变化忽略不计)____________________。
(3)生活中利用原电池原理生产了各种各样的电池,废电池必须进行集中处理的问题已被提到议事日程,其主要原因是________________。
A.回收利用电池外壳的金属
B.防止电池中汞、镉和铅等重金属离子对土壤、水源的污染
C.防止电池中渗漏的电解液腐蚀其他物品
D.回收其中石墨电极
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的![]() 与足量的碳在体积可变的恒压密闭容器中反应:
与足量的碳在体积可变的恒压密闭容器中反应:![]() ,平衡时,体系中气体体积分数与温度的关系如图所示,下列说法正确的是
,平衡时,体系中气体体积分数与温度的关系如图所示,下列说法正确的是
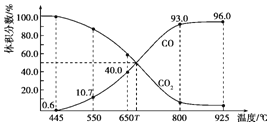
A.![]() 时,若充入惰性气体,
时,若充入惰性气体,![]() 、
、![]() 逆均减小,平衡不移动
逆均减小,平衡不移动
B.![]() 时,反应达平衡后
时,反应达平衡后![]() 的转化率为
的转化率为![]()
C.![]() 时,若充入等体积的
时,若充入等体积的![]() 和CO,平衡向逆反应方向移动
和CO,平衡向逆反应方向移动
D.平衡常数的关系:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,此反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、Cr2(SO4)3、K2SO4、H2O七种物质。
(1)若将碳纳米颗粒分散到一定溶剂中,形成稳定的分散系,其所具有的性质是__________。
①丁达尔效应 ②加入饱和(NH4)2SO4溶液产生聚沉 ③可通过半透膜
(2)请用上述物质填空,并配平化学方程式:____C+____+____H2SO4→____K2SO4+________+____Cr2(SO4)3+____H2O。
(3)H2SO4在上述反应中表现出来的性质是________(填选项编号)。
A.氧化性 B.氧化性和酸性
C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高血脂是一种常见的心血管疾病.治疗高血脂的新药I的合成路线如图所示:

已知:a.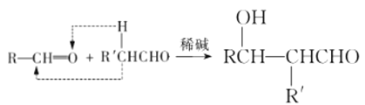 ;
;
b.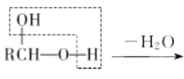 RCHO
RCHO
请回答下列问题:
(1)反应①所需试剂、条件分别是____。
(2)A→B的化学方程式为____。
(3)G的结构简式为____。
(4)化合物W的相对分子质量比化合物C大14。且满足下列条件.W的可能结构有___种。
①遇FeCl3溶液显紫色 ②属于芳香族化合物 ③能发生银镜反应
其中核磁共振氢谱显示有5种不同化学环境的氢.且峰面积比为2:2:2:1:1的结构简式为___
(5)设计用甲苯和乙醛为原料制备![]() 的合成路线,其他无机试剂任选(合成路线常用的表示方式为:A
的合成路线,其他无机试剂任选(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)____。
目标产物)____。
查看答案和解析>>
科目: 来源: 题型:
【题目】由U形管、质量为m g的铁棒、质量为m g的碳棒和1 L 0.2 mol·L-1 CuCl2溶液组成的装置如图所示,下列说法正确的是
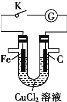
A.打开K,铁棒上有紫红色物质析出
B.闭合K,碳棒上有紫红色固体析出
C.闭合K,当电路中有0.3NA个电子通过时,理论上碳棒与铁棒的质量差为9.6 g
D.闭合K,铁棒表面发生的电极反应为Cu2++2e-=Cu
查看答案和解析>>
科目: 来源: 题型:
【题目】固体化合物CaFe(CO3)2在空气中加热反应生成CO2、Fe2O3和CaO.回答下列问题:
(1)CO2的电子式为_____。
(2)上述反应产物中的CaO加入燃煤中,其作用是_____。
A.降低温室效应B.减少SO2的排放C.避免光化学烟雾D.保护臭氧层
(3)设计实验证明上述固体产物中含有三价铁:取少量固体于试管中,_____。
(4)CaFe(CO3)2在空气中加热反应的化学方程式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在最新的家用汽车的调查中发现,新车中气体的质量不符合标准。汽车污染主要来源于汽车配件及材料,它们都会产生大量的有毒有机物。其中一种有毒物质为A,为了测定有机物A的结构,做如下实验:
①将9.2g该有机物完全燃烧,生成标况下15.68L的CO2和7.2g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;

(1)则由图可知该分子的相对分子质量是___,有机物A的分子式为____。
(2)用核磁共振仪处理该化合物得到四个峰,且面积之比是1∶2∶2:3,则有机物的名称为___,其苯环上的一氯代物有___种。若将有机物A与氢气完全加成,则加成后的有机物的一氯代物共有___种。
查看答案和解析>>
科目: 来源: 题型:
【题目】T℃时,向某恒容密闭容器中充入![]() 和
和![]() 发生反应:
发生反应:![]() ,反应历程与能量的变化如图所示,下列说法错误的是 ( )
,反应历程与能量的变化如图所示,下列说法错误的是 ( )
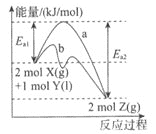
A.Y的质量不变时,该反应达到平衡状态
B.反应达到平衡时,放出的热量小于![]()
C.曲线b为加入催化剂时该反应的反应历程图
D.其他条件不变,平衡后再充入![]() ,达到新平衡时,Z的体积分数减小
,达到新平衡时,Z的体积分数减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com