
科目: 来源: 题型:
【题目】研究化学反应与能量的变化具有重要意义。
![]() 已知
已知![]() 的反应过程的能量变化如图1:
的反应过程的能量变化如图1:

![]() 该反应通常用
该反应通常用![]() 作为催化剂,加入
作为催化剂,加入![]() 会使图中的B点________
会使图中的B点________![]() 填“升高”、“不变”或“降低”
填“升高”、“不变”或“降低”![]() 。
。
![]() E
E![]() 表示的意义为___________。
表示的意义为___________。
![]() 如图2中的a和b为氢镍可充电碱性电池的电极,该电池总反应式为:
如图2中的a和b为氢镍可充电碱性电池的电极,该电池总反应式为:![]()
![]() 为了实现铜与稀硫酸反应,用Z通入氧气的同时,将开关K与Y相连即可。石墨电极的反应式为___________,总反应的化学方程式为__________。
为了实现铜与稀硫酸反应,用Z通入氧气的同时,将开关K与Y相连即可。石墨电极的反应式为___________,总反应的化学方程式为__________。
![]() 不通入氧气,直接将K与X相连也能实现铜与稀硫酸反应。则氢镍碱性电池的负极为____
不通入氧气,直接将K与X相连也能实现铜与稀硫酸反应。则氢镍碱性电池的负极为____![]() 填“a”或“b”
填“a”或“b”![]() ,电解槽内总反应的离子方程式为______________________。
,电解槽内总反应的离子方程式为______________________。
![]() 当给氢镍碱性电池充电时,该电池的正极反应式为______;氢镍电池放电时,负极附近的pH会________
当给氢镍碱性电池充电时,该电池的正极反应式为______;氢镍电池放电时,负极附近的pH会________![]() 填“变大”、“不变”或“变小”
填“变大”、“不变”或“变小”![]() 。
。
![]() 若将
若将![]() 题图2中的稀硫酸换成
题图2中的稀硫酸换成![]() 溶液,并且将氢镍碱性电池的电极反接,将K连接X,通电一段时间后,向所得溶液中加入
溶液,并且将氢镍碱性电池的电极反接,将K连接X,通电一段时间后,向所得溶液中加入![]() 碱式碳酸铜
碱式碳酸铜![]() 后,恰好恢复到原来的浓度和
后,恰好恢复到原来的浓度和![]() 不考虑
不考虑![]() 的溶解
的溶解![]() ,则电解过程中转移电子的物质的量为__________。
,则电解过程中转移电子的物质的量为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇又称“木醇”,是无色有酒精气味易挥发的有毒液体。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g)![]() CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g)![]() CO2(g)+2H2(g) △H=Q2kJ·mol-1
CO2(g)+2H2(g) △H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为______。
某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图:
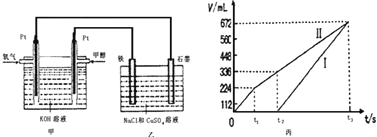
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为___________________________________。
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-。若过量的氯气为1×10-3mol,则理论上生成的SO42-为_____________mol。
(4)写出甲中通入甲醇这一极的电极反应式______________________。
(5)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式____________,原混合溶液中 NaCl的物质的量浓度为___________mol/L。(设溶液体积不变)
(6)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为_____________g。
(7)若使上述电解装置的电流强度达到5.0A,理论上每分钟应向负极通入气体的质量为_____________克。(已知1个电子所带电量为1.6×10-19C,计算结果保留两位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F、G、H八种前四周期元素,原子序数依次增大,A、B、F三者原子序数之和为25,且知B、F同主族,![]() 与G的气态氢化物的水溶液反应生成
与G的气态氢化物的水溶液反应生成![]() 氢气
氢气![]() 标准状况下
标准状况下![]() ,
,![]() 和E的离子具有相同的电子层结构,工业上用电解元素B和E能形成离子化合物的方法冶炼E单质,H元素常温下遇浓硫酸钝化,其一种核素质量数56,中子数30。试判断并回答下列问题:
和E的离子具有相同的电子层结构,工业上用电解元素B和E能形成离子化合物的方法冶炼E单质,H元素常温下遇浓硫酸钝化,其一种核素质量数56,中子数30。试判断并回答下列问题:
![]() 该元素在周期表中的位置__________ .
该元素在周期表中的位置__________ .
![]() 由F、G二种元素形成化合物
由F、G二种元素形成化合物![]() 的电子式______,含有化学键的类别为___________.
的电子式______,含有化学键的类别为___________.
![]() 、C、F形成的最简单气态氢化物沸点由低到高的顺序依次为________
、C、F形成的最简单气态氢化物沸点由低到高的顺序依次为________![]() 用化学式表示
用化学式表示![]()
![]() 由A、B、D、F四种元素可以组成两种盐,写出这两种盐反应的离子方程式__________
由A、B、D、F四种元素可以组成两种盐,写出这两种盐反应的离子方程式__________
![]() 在碱性条件下,G的单质可与
在碱性条件下,G的单质可与![]() 反应制备一种可用于净水的盐
反应制备一种可用于净水的盐![]() ,该反应的离子方程式是_______.
,该反应的离子方程式是_______.
![]() 熔融盐燃料电池用熔融的碳酸盐作为电解质,负极充入燃料气
熔融盐燃料电池用熔融的碳酸盐作为电解质,负极充入燃料气![]() ,用空气与
,用空气与![]() 的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。写出充入
的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。写出充入![]() 的一极发生反应的电极反应式______。
的一极发生反应的电极反应式______。
![]() 利用上述燃料电池,按图1所示装置进行电解,A、B、C、D均为铂电极,
利用上述燃料电池,按图1所示装置进行电解,A、B、C、D均为铂电极,

Ⅰ![]() 甲槽电解的是
甲槽电解的是![]() 一定浓度的NaCl与
一定浓度的NaCl与![]() 的混合溶液,理论上两极所得气体的体积随时间变化的关系如图2所示
的混合溶液,理论上两极所得气体的体积随时间变化的关系如图2所示![]() 气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计
气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计![]() 。
。![]() 的物质的量浓度为________
的物质的量浓度为________![]() 。
。
Ⅱ![]() 乙槽为
乙槽为![]() 溶液,通电一段时间,当C极析出
溶液,通电一段时间,当C极析出![]() 物质时停止通电,若使乙槽内的溶液完全复原,可向乙槽中加入________
物质时停止通电,若使乙槽内的溶液完全复原,可向乙槽中加入________![]() 填字母
填字母![]() 。
。
A ![]()
![]()
![]()
![]()
![]() 若通电一段时间后,向所得的乙槽溶液中加入
若通电一段时间后,向所得的乙槽溶液中加入![]() 的
的![]() 才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为________。
才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题。
(1)工业上常用活性炭还原一氧化氮,其反应为:2NO(g)+C(s)![]() N2(g)+CO2(g)。向容积均为lL的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g)。向容积均为lL的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min n(NO)/mol T | 0 | 40 | 80 | 120 | 160 | |
甲 | T℃ | 2 | 1.45 | 1 | 1 | 1 |
乙 | 400℃ | 2 | 1.5 | 1.1 | 0.8 | 0.8 |
丙 | 400℃ | 1 | 0.8 | 0.65 | 0.53 | 0.45 |
①甲容器反应温度T℃__400℃(填“>”或“<”或“=”);
②乙容器中,0~40min内平均反应速率v(N2)=__;
③丙容器中达平衡后NO的转化率为__。
(2)活性炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,lmolNO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,lmolNO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B、C三点中NO2的转化率最高的是__点(填“A”或“B”或“C”)。
②计算C点时该反应的压强平衡常数KP=__MPa(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)燃煤烟气脱硫常用如下方法。
方法①:用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g)=S(g)+2CO2(g) △H1=8.0kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H3=-483.6kJ·mol-1
则H2(g)还原SO2(g)生成S(g)和H2O(g)的热化学方程式为__。
方法②:用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4,则用氨水将SO2转化为NH4HSO3的离子方程式为__;实验测得NH4HSO3溶液中![]() =15,则溶液的pH为__。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
=15,则溶液的pH为__。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
查看答案和解析>>
科目: 来源: 题型:
【题目】化工生产和日常生活必须注意消防安全,下列行为不利于消防安全的是( )
A.天然气管道在输送天然气前先通入氦气
B.天然气中含“加臭剂“气体,用于警示气体泄露
C.用蘸浓氨水的棉棒检验输送氯气的管道是否泄露
D.用燃着的木条检验家用液化气钢瓶是否泄露
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是重要的资源,可以制备一系列物质。下列说法不正确的是( )

A.要除去粗盐中![]() 、
、![]() 、
、![]() 等杂质,步骤
等杂质,步骤![]() 中所加试剂及相关操作顺序可以是过量NaOH溶液
中所加试剂及相关操作顺序可以是过量NaOH溶液![]() 过量
过量![]() 溶液
溶液![]() 过量
过量![]() 溶液
溶液![]() 过滤
过滤![]() 盐酸
盐酸
B.步骤![]() 的反应原理为
的反应原理为![]()
![]()
![]()
C.步骤![]() 中需将
中需将![]() 置于干燥的HCl气流中加热脱水制备无水
置于干燥的HCl气流中加热脱水制备无水![]()
D.步骤![]() 、
、![]() 、
、![]() 所涉及的反应中,溴元素均发生氧化反应
所涉及的反应中,溴元素均发生氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】雾霾中含有多种污染物,包括氮氧化物![]() 、CO、
、CO、![]() 等。它们可以通过化学反应得到一定的消除或转化。
等。它们可以通过化学反应得到一定的消除或转化。
![]() 氮硫的氧化物的转化:
氮硫的氧化物的转化: ![]()
已知:![]()
![]()
![]() ,则
,则![]() _______
_______![]() 。
。
一定条件下,将![]() 与
与![]() 以一定比例置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的有_______。
以一定比例置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的有_______。
![]() 混合气体的密度不变
混合气体的密度不变 ![]() 混合气体的颜色保持不变
混合气体的颜色保持不变
![]() 和NO的体积比保持不变
和NO的体积比保持不变 ![]() 反应速率
反应速率![]()
![]() 碳氧化物的转化:
碳氧化物的转化:
![]() 可用于合成甲醇,反应方程式为:
可用于合成甲醇,反应方程式为:![]() ,在一恒温恒容密闭容器中充入
,在一恒温恒容密闭容器中充入![]() 和
和![]() 进行上述反应。测得CO和
进行上述反应。测得CO和![]() 浓度随时间变化如图1所示。
浓度随时间变化如图1所示。

则![]() 内,氢气的反应速率为____
内,氢气的反应速率为____![]() 第
第![]() 后,保持温度不变,向该密闭容器中再充入
后,保持温度不变,向该密闭容器中再充入![]() 和
和![]() ,则平衡_______
,则平衡_______![]() 填“正向”、“逆向”或“不”
填“正向”、“逆向”或“不”![]() 移动。
移动。
![]() 通过电解CO制备
通过电解CO制备![]() ,电解液为碳酸钠溶液,工作原理如图2所示,写出阴极的电极反应式_____。若以甲醇燃料电池作为电源,则生成标准状况下
,电解液为碳酸钠溶液,工作原理如图2所示,写出阴极的电极反应式_____。若以甲醇燃料电池作为电源,则生成标准状况下![]() 需要消耗
需要消耗![]() 的质量为_______。
的质量为_______。

![]() 硫氧化物的转化:硫的氧化物与一定量氨气、空气反应,可生成硫酸铵。硫酸铵水溶液呈酸性的原因是________________
硫氧化物的转化:硫的氧化物与一定量氨气、空气反应,可生成硫酸铵。硫酸铵水溶液呈酸性的原因是________________![]() 用离子方程式表示
用离子方程式表示![]() 室温时,向
室温时,向![]() 溶液中滴入NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系:
溶液中滴入NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系:![]() ____
____![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】卤族元素的单质和化合物很多,利用所学物质结构与性质的知识去认识和理解它们。
(1)溴的核外电子排布式为__。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在。使氢氟酸分子缔合作用力是___。
(3)下列曲线表示卤族元素某种性质随核电荷数递增的变化趋势,正确的是___。

(4)已知高碘酸有两种形式,化学式分别为H5IO6(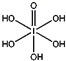 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6___HIO4(填“>”、“<”或“=”)。IO
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6___HIO4(填“>”、“<”或“=”)。IO![]() 的VSEPR模型为__。
的VSEPR模型为__。
(5)铜与氯形成化合物的晶胞如附图所示(黑点代表铜粒子)。

①该晶体的化学式为__。
②一定条件下,Cu2O比CuO更稳定的原因是__。
③已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体的边长为__pm。(用含ρ、NA的式子表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.汽油、煤油、柴油均可来自于石油的分馏
B.甲烷与氯气在一定条件下反应,经分离提纯后可得到四氯化碳
C.相同物质的量的乙炔和苯在足量的氧气中完全燃烧,消耗氧气的质量相同
D.煤气化生成的CO和![]() 再经过催化合成可得到液体燃料
再经过催化合成可得到液体燃料
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到检流计的指针发生了偏转。

请回答下列问题:
(1)甲池为________(填“原电池”、“电解池”或“电镀池”),通入CH3OH一极的电极反应式为_____________________________________________________________;
(2)乙池中A(石墨)电极的名称为________(填“正极”、“负极”、“阴极”或“阳极”),总反应式为_________________________________________________________;
(3)当乙池中B极质量增加5.40 g时,甲池中理论上消耗O2的体积为________ mL(标准状况),丙池中________极析出________ g铜;
(4)若丙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将________(填“增大”、“减小”或“不变”);丙中溶液的pH将________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com