
科目: 来源: 题型:
【题目】工业上利用废铝屑(含Al、Al2O3、Fe及Fe的氧化物)制取纯净的无水氯化铝,主要过程如下:
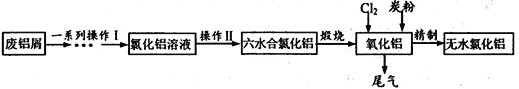
(1)检验氯化铝溶液中是否含有微量的Fe3+,可用的试剂为__________。
(2)操作II的步骤为__________、结晶、过滤、洗涤。
(3)煅烧过程的化学反应方程式为____________________。
(4)在强热条件下,Al2O3转化为AlCl3的反应如下:
Al2O3(s)+3Cl2(g)+3C(s)=2AlCl3(g)+3CO(g) △H>0
Al2O3(s)+3Cl2(g)+ ![]() C(s)=2AlCl3(g)+
C(s)=2AlCl3(g)+ ![]() CO2 (g) △H<0
CO2 (g) △H<0
工业上在通氯气的同时鼓入适量的氧气,其目的是:
①除去多余的碳粉;②_________。
(5)利用下列试剂设计由废铝制备氧化铝溶液的“一系列操作I”的实验方案:________。
实验中可供选择的试剂:6mol·L-1HCl溶液、3 mol·L-1H2SO4溶液、6mol·L-1NaOH溶液、氨水、H2O、CO2。
(6)AlCl3的熔点为190℃,沸点为183℃。1973年美国Alcoa公司研究出一种新的氯化铝电解制铝法。将AlCl3和NaCl、KCl、LiCl混溶电解冶炼铝,其中NaCl、KCl、LiC的作用是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】请回答下列关于有机实验的问题。
(1)甲同学进行淀粉水解实验,为了检验淀粉水解的产物,设计如下实验方案:
![]()
①试剂1为20%的H2SO4溶液,其作用是__________________________。
②有同学忘记加试剂2,在实验最后没有看到砖红色的现象,原因是__________________。
③若要检验淀粉是否完全水解,在_______(填图中框内物质)中加入_______(填试剂名称)试剂。
(2)乙同学进行苯的硝化反应。实验流程如图顺序。已知:硝基苯沸点为210℃,蒸馏分离时选用空气冷凝管。
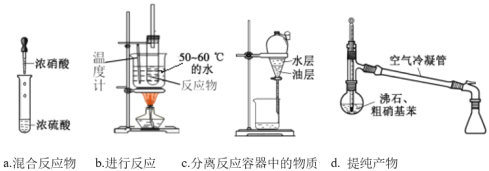
①写出苯的硝化反应的方程式:_______。
②d的蒸馏操作中加入沸石的作用是_______。
③上述操作或者装置中有错误的是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于如图所示的原电池,下列说法正确的是( )
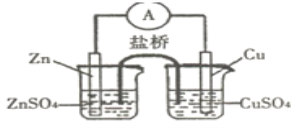
A.电子从锌电极通过电流表流向铜电极
B.盐桥中的阳离子向硫酸锌溶液中迁移
C.锌电极发生氧化反应,铜电极发生还原反应,其电极反应是2H+2e=H2↑
D.取出盐桥后,电流表仍会偏转,铜电极在反应前后质量不变
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列有关叙述正确的是( )
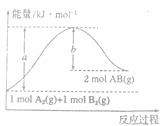
A.每生成2molAB(g)吸收bkJ热量
B.该反应中反应物的总能量高于生成物的总能量
C.反应热ΔH=+(a-b)kJ/mol
D.形成1molA-A键和1mo1B-B键,吸收akJ能量
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是
A.恒温时,向水中加入少量固体硫酸氢钠,c(H+)增大,水的离子积常数Kw不变
B.0.1mol/L CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.对于N2(g)+3H2(g)![]() 2NH3(g),其他条件不变,充入N2,正反应速率增大,逆反应速率减小
2NH3(g),其他条件不变,充入N2,正反应速率增大,逆反应速率减小
D.在硫酸钡悬浊液中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于甲、乙、丙、丁四种有机物的说法正确的是
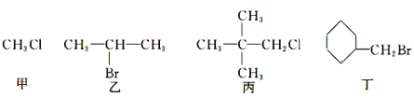
A.甲中加入AgNO3溶液,有沉淀生成
B.乙发生消去反应得到两种烯烃
C.丙中加入NaOH醇溶液共热,后加入稀硝酸至酸性,再滴入AgNO3溶液,有沉淀生成
D.丁加入NaOH溶液共热,然后加入稀硝酸调至酸性,再滴入AgNO3溶液,有沉淀生成
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A.NH4Cl![]() NH3↑+HCl↑B.2Na2O2+2CO2=2Na2CO3+O2
NH3↑+HCl↑B.2Na2O2+2CO2=2Na2CO3+O2
C.2NaOH+Cl2=NaCl+NaClO+H2OD.NH3+CO2+H2O=NH4HCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】以硅藻土为载体的五氧化二钒![]() 是接触法生成硫酸的催化剂。从废钒催化剂中回收
是接触法生成硫酸的催化剂。从废钒催化剂中回收![]() 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 |
|
|
|
|
|
|
质量分数 |
|
|
|
|
|
|
以下是一种废钒催化剂回收工艺路线:
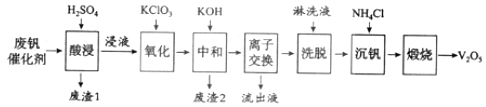
回答下列问题:
![]() 五氧化二钒是一种催化剂,可将
五氧化二钒是一种催化剂,可将![]() 转化为
转化为![]() ,请写出该反应的化学方程式______。
,请写出该反应的化学方程式______。
![]() “酸浸”时
“酸浸”时![]() 转化为
转化为![]() ,反应的离子方程式为______,同时
,反应的离子方程式为______,同时![]() 转成
转成![]() “废渣1”的主要成分是______。
“废渣1”的主要成分是______。
![]() “氧化”中欲使3mol的
“氧化”中欲使3mol的![]() 变为
变为![]() ,则需要氧化剂
,则需要氧化剂![]() 至少为______mol。
至少为______mol。
![]() “中和”作用之一是使钒以
“中和”作用之一是使钒以![]() 形式存在于溶液中。“废渣2”中含有______。
形式存在于溶液中。“废渣2”中含有______。
![]() “流出液”中阳离子最多的是______。
“流出液”中阳离子最多的是______。
![]() “沉钒”得到偏钒酸铵
“沉钒”得到偏钒酸铵![]() 沉淀,写出“煅烧”中发生反应的化学方程式______。
沉淀,写出“煅烧”中发生反应的化学方程式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在工业生产上中,主要用Na2SO3制造亚硫酸纤维素酯、硫代硫酸钠、有机化学药品、漂白织物等。但Na2SO3在空气中易氧化为Na2SO4而变质。为了求出变质样品中Na2SO3的含量,采用0.2 mol·L-1KMnO4酸性溶液滴定用样品配制的溶液。反应离子方程式是:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O,称取20 g样品,配成250 mL溶液,量取25 mL进行滴定,记录数据,再重复2次实验。
填空完成问题:
(1)滴定实验不需要下列仪器中的________。
A.酸式滴定管(50 mL) B.碱式滴定管(50 mL) C.量筒(10 mL) D.锥形瓶 E.铁架台 F.滴定管夹
G.白纸 H.玻璃棒
(2)已知滴定过程不需要指示剂,理由是_______________________。
(3)下列操作中可能使所测Na2SO3溶液的浓度数值偏低的是________(填字母)。
A.盛放Na2SO3溶液的滴定管没有使用Na2SO3溶液润洗
B.锥形瓶内有水残留,没有烘干,装入待测的Na2SO3溶液滴定
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
(4)滴定完毕,三次实验平均消耗0.2 mol·L-1KMnO4酸性溶液20.00mL,则样品中Na2SO3的百分含量为:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,一定量的石灰乳悬浊液中存在下列平衡:Ca(OH)2(s)![]() Ca(OH)2(aq)
Ca(OH)2(aq)![]() Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是
A. n (Ca2+)增大 B. c(Ca2+)不变
C. c(OH-)增大 D. n(OH-)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com