
科目: 来源: 题型:
【题目】向AgCl浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成。经查资料得知:Ag++ 2NH3·H2O![]() Ag(NH3)2+ 2H2O。下列分析不正确的是
Ag(NH3)2+ 2H2O。下列分析不正确的是
A. 浊液中存在沉淀溶解平衡:AgCl (s)![]() Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
B. 实验可以证明NH3结合Ag+能力比Cl-强
C. 实验表明实验室可用氨水洗涤银镜反应后的试管
D. 由资料信息可推知:加浓硝酸后生成的沉淀为AgCl
查看答案和解析>>
科目: 来源: 题型:
【题目】中国航空航天事业飞速发展,银铜合金广泛用于航空工业。从银铜合金切割废料中回收银并制备铜化工产品的工艺如下:
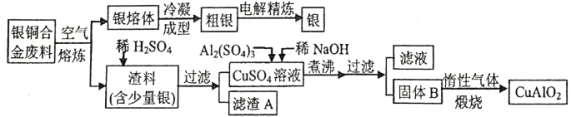
注:A1(OH)3和Cu(OH)2分解温度分别为450℃和80℃
(1)在电解精炼银时,阳极材料为___________。
(2)加快渣料(含少量银)溶于稀H2SO4速率的措施为___________(写出两种)。
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为______________________。
(4)过滤操作需要的玻璃仪器除烧杯外还有___________。
(5)固体混合物B的组成为___________;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为___________。
(6)煅烧阶段通入惰性气体的原因___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子.在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2·2CO·2H2O
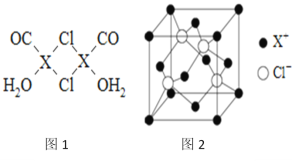
(1)X基态原子的电子排布式为__________________.
(2)C、H、O三种原子的电负性由大到小的顺序为__________.
(3)X2Cl2·2CO·2H2O是一种配合物,其结构如图1所示:
①与CO为互为等电子体的分子是_________.
②该配合物中氯原子的杂化方式为__________.
③在X2Cl22CO2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键_____________.
(4)阿伏加德罗常数的测定有多种方法,X射线衍射法就是其中的一种。通过对XCl晶体的X射线衍射图象的分析,可以得出XCl的晶胞如图2所示,则距离每个X+最近的Cl﹣的个数为____________,若X原子的半径为a pm,晶体的密度为ρg/cm3,试通过计算阿伏加德罗常数NA=___________________(列计算式表达)
查看答案和解析>>
科目: 来源: 题型:
【题目】欲增加Mg(OH)2在水中的溶解,可采用的方法是 ( )
A.增加溶液pHB.加入2.0mol/L NH4Cl
C.加入0.1mol/L MgSO4D.加入适量95%乙醇
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,将锌、铜通过导线相连,置于稀硫酸中:
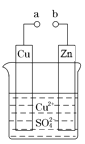
(1)锌片上的现象是______,电极反应为________。
(2)铜片上的现象是_________,电极反应为_________。
(3)电子由________经导线流向_____________。
(4)若反应过程中有0.2 mol电子发生转移,则生成的氢气在标准状况下的体积为 ______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于H2S叙述不正确的是( )
A. H2S热稳定性差,在加热条件下会分解为硫单质与氢气
B. 部分金属硫化物不溶于酸,将硫化氢通入CuSO4、FeSO4等溶液中会出现黑色沉淀
C. H2S具有毒性,可以用湿润的醋酸铅试纸检验H2S
D. 久置的氢硫酸溶液易变质,是因为H2S具有很强的还原性,被空气中的O2氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.在含有![]() 沉淀的溶液中加入
沉淀的溶液中加入![]() 固体,
固体,![]() 增大
增大
C.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
D.物质的溶解度随温度的升高而增加,物质的溶解都是吸热的
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物种类多种多样,具有广泛的应用价值。回答下列问题。
(1)用乙烯、己烷、乙酸乙酯、甲酸、葡萄糖、麦芽糖6种物质名称回答下列问题。
①作为衡量国家石油工业水平标志的物质是______________。
②能因为萃取而使溴水褪色的是____________________。
③能发生水解反应的是_____________________。
④加热条件下,能与新制Cu(OH)2悬浊液反应生成砖红色沉淀的是____________。
(2)已知:RCHO+R′CH2CHO![]()
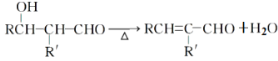 ,请写出苯甲醛与丙醛在上述条件下反应,得到有机产物的结构简式____________。
,请写出苯甲醛与丙醛在上述条件下反应,得到有机产物的结构简式____________。
(3)已知:![]()
Nomex纤维是一种新型阻燃性纤维。可由间苯二甲酸(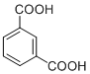 )和间苯二胺(
)和间苯二胺(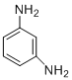 )在一定条件下以等物质的量缩聚合成得到。则Nomex纤维结构简式为____________。
)在一定条件下以等物质的量缩聚合成得到。则Nomex纤维结构简式为____________。
(4)下列物质的反应,不属于取代反应的是____________。(填序号)
A. +H2O
+H2O
B.CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
C.CH3COOH+CH3OH![]() CH3COOCH3+H2O
CH3COOCH3+H2O
D. [式中R为CH3(CH2)15CH2—]
[式中R为CH3(CH2)15CH2—]
查看答案和解析>>
科目: 来源: 题型:
【题目】钙钛矿(主要成分是CaTiO3)太阳能薄膜电池制备工艺简单、成本低、效率高,引起了科研工作者的广泛关注,科学家认为钙钛矿太阳能电池将取代硅基太阳能电池的统治地位。
(1)基态钛原子的电子排布式为______,若钙原子核外有7种能量状态的电子,则钙原子处于____(填“基”或“激发”)态,氧元素所在周期第一电离能由小到大的前三种元素依次是_______。
(2)硅能形成一系列硅氢化合物,如硅烷系列:SiH4、Si2H6;硅烯系列:Si2H4、Si3H6等,其中硅烷广泛应用于微电子、制造太阳能电池。
①上述分子中硅原子存在sp2杂化的是____,属于正四面体的是_____。
②硅烷链长度远小于烷烃,最可能的原因是______,硅烷同系物熔、沸点的变化规律可能是________.
(3) CaTiO3的晶胞为立方晶胞,结构如下图所示:
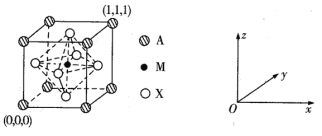
则与A距离最近且相等的X有___个,M的坐标是_____;若晶胞参数是r pm, NA为阿伏加德罗常数的值,则该晶体的密度是_____g/cm3。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列8种化学符号:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
(1)表示核素的符号共________种。
(2)互为同位素的是________和________。
(3)质量数相等,但不能互称同位素的是________和________。
(4)中子数相等,但质子数不相等的核素是________和________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com