
科目: 来源: 题型:
【题目】高纯MnCO3是广泛用于电子行业的强磁性材料。MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于100℃开始分解。
Ⅰ.实验室以MnO2为原料制备MnCO3
(1)制备MnSO4溶液:
①主要反应装置如图,缓缓通入经N2稀释的SO2气体,发生反应H2SO3+MnO2![]() MnSO4+H2O。下列措施中,目的是加快化学反应速率的是________(填标号)。
MnSO4+H2O。下列措施中,目的是加快化学反应速率的是________(填标号)。
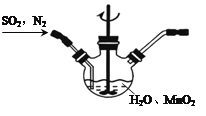
A.MnO2加入前先研磨 B.搅拌 C.提高混合气中N2比例
②已知实验室制取SO2的原理是Na2SO3+2H2SO4(浓)![]() 2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置有________(填标号)。
2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置有________(填标号)。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
③若用空气代替N2进行实验,缺点是________。(酸性环境下Mn2+不易被氧化)
(2)制备MnCO3固体:
实验步骤:①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤;② ……;③在70-80℃下烘干得到纯净干燥的MnCO3固体。
步骤②需要用到的试剂有________。
Ⅱ.设计实验方案
(3)利用沉淀转化的方法证明KSP(MnCO3) < KSP(NiCO3):________。
(已知NiCO3为难溶于水的浅绿色固体)
(4)证明H2SO4的第二步电离不完全:________。[查阅资料表明K2(H2SO4)=1.1×10-2]
查看答案和解析>>
科目: 来源: 题型:
【题目】中华人民共和国国家标准(G2762011)规定葡萄酒中c最大使用量为0.25g/L.某兴趣小组用图装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定。
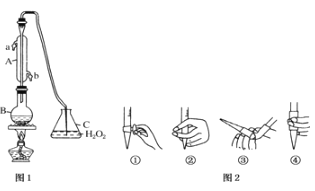
(1)仪器A的名称是________,水通入A的进口为_______________
(2)B中加入300.0ml葡萄酒和适量盐酸,加热使SO2全部逸出与C中H2O2完全反应其化学方程式为_________________________________
(3)除去C中过量的H2O2,然后用0.0900mol/LNaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________;若用50mL滴定管进行实验,当滴定管中的液面在刻度“20”处,则管内液体的体积______(填序号)
(①=20mL,②=30mL,③<20mL,④>30mL).
(4)滴定至终点时,消耗NaOH溶液12.50mL,该葡萄酒中SO2含量为:___g/L
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施______________
查看答案和解析>>
科目: 来源: 题型:
【题目】将1.60gCuSO4固体在高温下加热,得到0.72g红色固体(纯净物,不含S元素),同时有气体X生成,X可能是SO2、SO3、O2中的两种或三种。下列说法正确的是
A.所得红色固体是铜
B.将X通入氢氧化钡溶液,若溶液变浑浊,则X中含有SO3
C.X的物质的量最少为0.01mol
D.将X缓慢通过足量NaOH溶液,若溶液增重0.72g,则X中含0.005molO2
查看答案和解析>>
科目: 来源: 题型:
【题目】锂的某些化合物是性能优异的材料。请回答:
(1)如图是某电动汽车电池正极材料的晶胞结构示意图,其化学式为 ______ ,其中![]() 的基态电子排布式为 ______ ,
的基态电子排布式为 ______ ,![]() 的空间构型为 ______ 。
的空间构型为 ______ 。
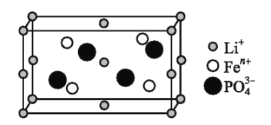
(2)![]() 与Na中第一电离能较小的元素是 ______ ;LiF与NaCl晶体中熔点较高的是 ______ 。
与Na中第一电离能较小的元素是 ______ ;LiF与NaCl晶体中熔点较高的是 ______ 。
(3)氮化锂是一种良好的储氢材料,其在氢气中加热时可吸收氢气得到氨基锂![]() 和氢化锂,氢化锂的电子式为 ______ ,上述反应的化学方程式为 ______。
和氢化锂,氢化锂的电子式为 ______ ,上述反应的化学方程式为 ______。
(4)金属锂为体心立方晶胞,其配位数为 ______ ;若其晶胞边长为apm,则锂晶体中原子的空间占有率是 ______ 。
(5)有机锂试剂在有机合成中有重要应用,但极易与![]() 、
、![]() 等反应.下列说法不正确的是 ______
等反应.下列说法不正确的是 ______ ![]() 填字母序号
填字母序号![]() 。
。
A.CO2中σ键与π键的数目比为1:1
B.游离态和化合态锂元素均可由特征发射光谱检出
C.叔丁基锂(C4H9Li)中碳原子的杂化轨道类型为sp3和sp2。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应属于取代反应的是
A.CH4+2O2![]() CO2+2H2O
CO2+2H2O
B.CH2=CH2+H2![]() CH3CH3
CH3CH3
C.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.![]() +HO-NO2
+HO-NO2![]()
 +H2O
+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】硼元素、钙元素、铜元素在化学中有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用。
![]() 已知
已知![]() 与水反应生成乙炔。请回答下列问题:
与水反应生成乙炔。请回答下列问题:
![]() 将乙炔通入
将乙炔通入![]() 溶液中生成
溶液中生成![]() 红棕色沉淀,
红棕色沉淀,![]() 基态核外电子排布式为 ______ ,其在酸性溶液中不稳定,可发生歧化反应生成
基态核外电子排布式为 ______ ,其在酸性溶液中不稳定,可发生歧化反应生成![]() 和Cu,但CuO在高温下会分解成
和Cu,但CuO在高温下会分解成![]() ,试从结构角度解释高温下CuO何会生成
,试从结构角度解释高温下CuO何会生成![]() :______。
:______。
![]() 中
中![]() 与
与![]() 互为等电子体,
互为等电子体,![]() 中含有的
中含有的![]() 键数目为 ______ 。
键数目为 ______ 。
![]() 乙炔与氢氰酸反应可得丙烯腈
乙炔与氢氰酸反应可得丙烯腈![]() 丙烯腈分子中碳原子轨道杂化类型是 ______ ,构成丙烯腈元素中第一电离能最大的是 ______ 。
丙烯腈分子中碳原子轨道杂化类型是 ______ ,构成丙烯腈元素中第一电离能最大的是 ______ 。
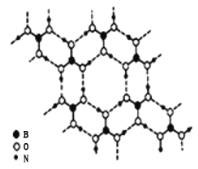
![]() 硼酸
硼酸![]() 是一种片层状结构的白色晶体,层内的
是一种片层状结构的白色晶体,层内的![]() 分子间通过氢键相连
分子间通过氢键相连![]() 如图
如图![]() 则
则![]() 的晶体中有 ______ mol氢键。硼酸溶于水生成弱电解质一水合硼酸
的晶体中有 ______ mol氢键。硼酸溶于水生成弱电解质一水合硼酸![]() ,它电离生成少量
,它电离生成少量![]() 和
和![]() ,则
,则![]() 含有的化学键类型为 ______ 。
含有的化学键类型为 ______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜、镁、金等的相关物质在生产生活中具有重要的作用。回答下列问题:
(1)铜元素在周期表中的位置是___________,基态铜原子中,核外电子占据最高能层的符号是___________,占据该最高能层的电子数为___________。
(2)在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、 Cu5Zn8等。某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于___________(填“晶体”或“非晶体”)
(3)铜能与类卤素[(SCN)2]反应生成Cu(SCN)2,lmol(SCN)2分子中含有σ键的数目为___________。(SCN)2对应的酸有硫氰酸(H-S-C≡N)、异硫氰酸(H-N=C=S)两种。理论上前者沸点低于后者,其原因是____________________________________________。
(4)铜与金形成的金属互化物的晶胞结构如图1所示,其晶胞边长为anm,该金属互化物的密度为___________(用含a、NA的代数式表示)g·cm-3。

(6)某金属晶体中原子的堆积方式为六方最密堆积如图2所示,晶胞可用图3表示。已知该金属的原子半径为acm,该金属晶胞的高为bcm:若以晶胞中A点原子为原点建立空间直角坐标系o-xyz,则A点原子的坐标为(0,0,0),C点原子的坐标为(2a,0,0),D点原子的坐标为(0,0,b),则B点原子的坐标为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______________方法区分晶体、准晶体和非晶体。
(2)Fe的基态原子有________个未成对电子,Fe3+的电子排布式为__________________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为__________。
(3)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化为乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为________,1mol乙醛分子中含有的σ键的数目为__________。乙酸的沸点明显高于乙醛,其主要原因是____________________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有________个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为________。列式表示Al单质的密度_________________________________________________g/cm3(不必计算出结果)。
查看答案和解析>>
科目: 来源: 题型:
【题目】苹果酸(a-羟基丁二酸)是一种健康食品饮料,结构为: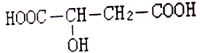 ,下列关于苹果酸的说法不正确的是
,下列关于苹果酸的说法不正确的是
A. 在铜或银作催化剂条件下加热,能与氧气反应
B. 在一定条件下能形成环状有机化合物
C. 在氢氧化钠的乙醇溶液中加热,能发生消去反应
D. 能发生缩聚反应
查看答案和解析>>
科目: 来源: 题型:
【题目】根据图1、图2、图3及题中信息,回答下列问题
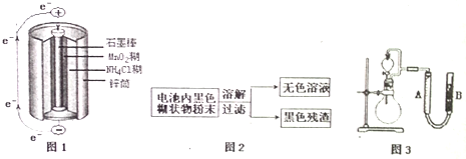
![]() 图1是锌锰干电池基本构造图,该电池的负极材料是 ______ ;工作时
图1是锌锰干电池基本构造图,该电池的负极材料是 ______ ;工作时![]() 离子在正极放电产生两种气体,其中一种气体分子是含
离子在正极放电产生两种气体,其中一种气体分子是含![]() 的微粒,正极的电极反应式是 ______ ;当电路中每通过
的微粒,正极的电极反应式是 ______ ;当电路中每通过![]() ,负极质量减少 ______ ;
,负极质量减少 ______ ;
![]() 图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣
图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣![]() 的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有 ______ ;
的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有 ______ ;
![]() 图3是探究
图3是探究![]() 在制
在制![]() 过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表
过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表![]() 已知:两次实验气体的体积在相同条件下测定:
已知:两次实验气体的体积在相同条件下测定:![]() 由分液漏斗滴入到圆底烧瓶
由分液漏斗滴入到圆底烧瓶![]() 。
。
序号 | 烧瓶中的物质 | 实验记录 | 实验结论 |
实验一 | 足量 |
|
|
实验二 | 足量 |
|
|
![]() 在测量气体体积时,除要注意待气体温度恢复至室温、平视度数外,还需要注意 ______ ;
在测量气体体积时,除要注意待气体温度恢复至室温、平视度数外,还需要注意 ______ ;
![]() 实验一、二中参加反应的
实验一、二中参加反应的![]() 的物质的量之比为 ______ 。
的物质的量之比为 ______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com