
科目: 来源: 题型:
【题目】已知一定温度下,2X(g)+Y(g) ![]() mZ(g) ΔH=-a kJ/mol(a>0),现有甲、乙两容积相等且固定不变的密闭容器,在保持该温度下,向密闭容器甲中通入2 mol X和1 mol Y,达到平衡状态时,放出热量b kJ,向密闭容器乙中通入1 mol X和0.5 mol Y,达到平衡时,放出热量c kJ,且b>2c,则a、b、m的值或关系正确的是
mZ(g) ΔH=-a kJ/mol(a>0),现有甲、乙两容积相等且固定不变的密闭容器,在保持该温度下,向密闭容器甲中通入2 mol X和1 mol Y,达到平衡状态时,放出热量b kJ,向密闭容器乙中通入1 mol X和0.5 mol Y,达到平衡时,放出热量c kJ,且b>2c,则a、b、m的值或关系正确的是
A. m = 4 B. a = b C. a < ![]() D. m < 3
D. m < 3
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气的无害化处理已成为当今汽车工业的一项重要课题,其基本原理是实现2NO(g)+2CO(g)![]() N2(g)+2CO2(g)的反应.关于该反应,下列说法正确的是
N2(g)+2CO2(g)的反应.关于该反应,下列说法正确的是
A.只要使用合理的催化剂及载体,就可完全清除NO和CO
B.使用性能好的催化剂可使反应的反应热增大
C.假设该反应在密闭容器中进行,一段时间后达到平衡时c(NO)=c(CO)
D.该反应达到平衡时v(NO)正=v(CO)逆
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组热化学方程式中,△H1>△H2的是( )
①C(s)+O2(g)=CO2(g) △H1 C(s)+![]() O2(g)=CO(g) △H2
O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H1 S(g)+O2(g)=SO2(g) △H2
③H2(g)+![]() O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
④CaCO3(s)=CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)=Ca(OH)2(s) △H2
A.①B.④C.②③④D.①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识.下图是某化学兴趣小组设计的乙醇催化氧化的实验装置。(提示:通常用新制的Cu(OH)2悬浊液产生砖红色沉淀来检验物质中含有醛基)。
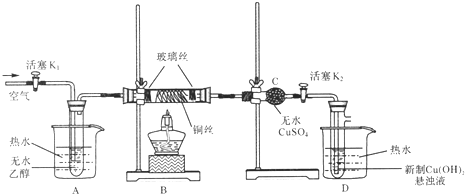
请据图回答以下问题:
(1)仪器连接安装完毕,进行实验前如何检验装置的气密性?答:_____________;
(2)对A中的乙醇采用水浴加热的目的是____________;
(3)实验时,点燃B处的酒精灯后,先____________,再集中火焰加热铜丝,随后向装置中不断地缓缓鼓入空气,此时B中观察到的现象是____________,发生的主要反应的化学方程式为____________,当反应进行一段时间后,移去酒精灯,继续不断缓缓地鼓入空气,B中仍重复如上现象,说明B处发生的反应是一个____________反应(填“吸热”或“放热”).
(4)装置C的作用是____________,能在此处观察到的现象是____________;
(5)装置D中的现象是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A.已知NaOH(aq)+HCl(aq)=![]()
![]() H=-57.3
H=-57.3![]() 则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量
则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量
B.已知2H2(g)+O2(g)=2H2O(g) ![]() H=-483.6
H=-483.6![]()
![]() 则氢气的燃烧热为241.8
则氢气的燃烧热为241.8![]()
C.已知![]() =
=![]()
![]() H=a
H=a![]()
![]() ===2CO(g)
===2CO(g)![]() H=b
H=b![]() 则a>b
则a>b
D.已知P(白磷,s)=P(红磷,s)![]() H<0,则白磷比红磷稳定
H<0,则白磷比红磷稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应A2+B2=2AB的能量变化如下图所示,则下列说法不正确的是( )
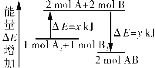
A.该反应是放热反应
B.断裂2 mol A—B键需要吸收![]() kJ的能量
kJ的能量
C.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
D.断裂1 mol A-A键和1 mol B-B键能吸收![]() kJ的能量
kJ的能量
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯![]() 是广泛用于电子行业的强磁性材料.
是广泛用于电子行业的强磁性材料.![]() 为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于
为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于![]() 开始分解。
开始分解。
Ⅰ![]() 实验室以
实验室以![]() 为原料制备
为原料制备![]()
![]() 制备
制备![]() 溶液:
溶液:
![]() 主要反应装置如图1,缓缓通入经
主要反应装置如图1,缓缓通入经![]() 稀释的
稀释的![]() 气体,发生反应
气体,发生反应![]() ,下列措施中,目的是加快化学反应速率的是______
,下列措施中,目的是加快化学反应速率的是______![]() 填标号
填标号![]() 。
。
A.![]() 加入前先研磨
加入前先研磨![]() 搅拌
搅拌![]() 提高混合气中
提高混合气中![]() 比例
比例
![]() 已知实验室制取
已知实验室制取![]() 的原理是
的原理是![]() 浓
浓![]()
![]()
![]() 选择如图2所示部分装置与图装1置相连制备
选择如图2所示部分装置与图装1置相连制备![]() 溶液,应选择的装置有______
溶液,应选择的装置有______![]() 填标号
填标号![]() .
.
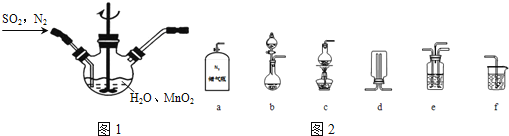
![]() 若用空气代替
若用空气代替![]() 进行实验,缺点是______
进行实验,缺点是______![]() 酸性环境下
酸性环境下![]() 不易被氧化
不易被氧化![]()
![]() 制备
制备![]() 固体:
固体:
实验步骤:![]() 向
向![]() 溶液中边搅拌边加入饱和
溶液中边搅拌边加入饱和![]() 溶液生成
溶液生成![]() 沉淀,反应结束后过滤;
沉淀,反应结束后过滤;![]() ;
;![]() 在
在![]() 下烘干得到纯净干燥的
下烘干得到纯净干燥的![]() 固体。
固体。
步骤![]() 需要用到的试剂有______。
需要用到的试剂有______。
Ⅱ![]() 设计实验方案
设计实验方案
![]() 利用沉淀转化的方法证明
利用沉淀转化的方法证明![]() :______
:______![]() 已知
已知![]() 为难溶于水的浅绿色固体
为难溶于水的浅绿色固体![]()
![]() 证明
证明![]() 的第二步电离不完全:______
的第二步电离不完全:______![]() 查阅资料表明
查阅资料表明![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】根据图1、图2、图3及题中信息,回答下列问题
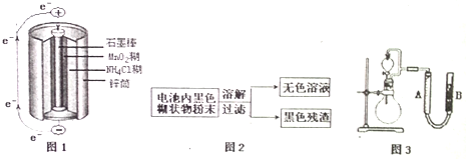
![]() 图1是锌锰干电池基本构造图,该电池的负极材料是 ______ ;工作时
图1是锌锰干电池基本构造图,该电池的负极材料是 ______ ;工作时![]() 离子在正极放电产生两种气体,其中一种气体分子是含
离子在正极放电产生两种气体,其中一种气体分子是含![]() 的微粒,正极的电极反应式是 ______ ;当电路中每通过
的微粒,正极的电极反应式是 ______ ;当电路中每通过![]() ,负极质量减少 ______ ;
,负极质量减少 ______ ;
![]() 图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣
图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣![]() 的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有 ______ ;
的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有 ______ ;
![]() 图3是探究
图3是探究![]() 在制
在制![]() 过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表
过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表![]() 已知:两次实验气体的体积在相同条件下测定:
已知:两次实验气体的体积在相同条件下测定:![]() 由分液漏斗滴入到圆底烧瓶
由分液漏斗滴入到圆底烧瓶![]() 。
。
序号 | 烧瓶中的物质 | 实验记录 | 实验结论 |
实验一 | 足量 |
|
|
实验二 |
|
|
|
![]() 在测量气体体积时,除要注意待气体温度恢复至室温、平视度数外,还需要注意 ______ ;
在测量气体体积时,除要注意待气体温度恢复至室温、平视度数外,还需要注意 ______ ;
![]() 实验一、二中参加反应的
实验一、二中参加反应的![]() 的物质的量之比为 ______ 。
的物质的量之比为 ______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 时,2L密闭容器中充入
时,2L密闭容器中充入![]()
![]() ,发生反应:
,发生反应:![]() ,获得如下数据:下列判断正确的是
,获得如下数据:下列判断正确的是![]()
时间 | 0 | 20 | 40 | 60 | 80 | 100 |
|
|
|
|
|
|
|
A.![]() 内,
内,![]()
B.在相同条件下,开始时若向容器中充入的是![]()
![]() ,达到平衡后
,达到平衡后![]() 的转化率为
的转化率为![]()
C.反应达平衡时,吸收的热量为![]() kJ
kJ
D.100s时再通入![]() mol
mol![]() ,达新平衡时
,达新平衡时![]() 的转化率增大
的转化率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
容器编号 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为![]()
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com