
ΓΨΧβΡΩΓΩœύΆ§Έ¬Ε»œ¬Θ§ΧεΜΐΨυΈΣ0.25 LΒΡΝΫΗωΚψ»ίΟή±’»ίΤς÷–ΖΔ…ζΩ…ΡφΖ¥”ΠΘΚN2(g)ΘΪ3H2(g) ![]() 2NH3(g)ΓΓΠΛHΘΫΘ≠92.6 kJΓΛmolΘ≠1ΓΘ Β―ι≤βΒΟΤπ ΦΓΔΤΫΚβ ±ΒΡ”–ΙΊ ΐΨί»γœ¬±μΥυ ΨΘΚ
2NH3(g)ΓΓΠΛHΘΫΘ≠92.6 kJΓΛmolΘ≠1ΓΘ Β―ι≤βΒΟΤπ ΦΓΔΤΫΚβ ±ΒΡ”–ΙΊ ΐΨί»γœ¬±μΥυ ΨΘΚ
»ίΤς±ύΚ≈ | Τπ Φ ±ΗςΈο÷ ΒΡΈο÷ ΒΡΝΩ/mol | ¥οΤΫΚβ ±ΧεœΒΡήΝΩΒΡ±δΜ· | ||
N2 | H2 | NH3 | ||
ΔΌ | 1 | 3 | 0 | Ζ≈≥ω»»ΝΩΘΚ23.15 kJ |
ΔΎ | 0.9 | 2.7 | 0.2 | Ζ≈≥ω»»ΝΩΘΚQ |
œ¬Ν––π ω¥μΈσΒΡ «
A.»ίΤςΔΌΓΔΔΎ÷–Ζ¥”ΠΒΡΤΫΚβ≥Θ ΐœύΒ»
B.ΤΫΚβ ±Θ§ΝΫΗω»ίΤς÷–NH3ΒΡΧεΜΐΖ÷ ΐΨυΈΣ![]()
C.»ίΤςΔΎ÷–¥οΤΫΚβ ±Ζ≈≥ωΒΡ»»ΝΩQΘΫ23.15 kJ
D.»τ»ίΤςΔΌΒΡΧεΜΐΈΣ0.5 LΘ§‘ρΤΫΚβ ±Ζ≈≥ωΒΡ»»ΝΩ–Γ”Ύ23.15 kJ
ΓΨ¥πΑΗΓΩC
ΓΨΫβΈωΓΩ
ΤΫΚβ≥Θ ΐ÷Μ”κΈ¬Ε»”–ΙΊΘ§”κΤπ ΦΝΩΈόΙΊΘ§ΗυΨί±μ÷–ΒΡ ΐΨίΘ§άϊ”Ο»ΐΕΈΖ®Ϋχ––ΦΤΥψΘΜ
A. Ζ¥”ΠΒΡΈ¬Ε»ΟΜ”–ΖΔ…ζ±δΜ·Θ§K≤Μ±δΘ§Aœν’ΐ»ΖΘΜ
B. ”…ΔΌΩ…÷ΣΘ§Ζ≈≥ω23.15 kJΒΡ»»ΝΩ ±Θ§…ζ≥…NH3ΒΡΈο÷ ΒΡΝΩΈΣ![]() =0.5molΘ§
=0.5molȧ
N2(g) ΘΪ 3H2(g) ![]() 2NH3(g)
2NH3(g)
ΦΘ®molΘ© 1 3 0
ΉΣΘ®molΘ© 0.25 0.75 0.5
ΤΫΘ®molΘ© 0.75 2.25 0.5
“ρΧεΜΐ÷°±»Β»”ΎΈο÷ ΒΡΝΩ÷°±»Θ§Υυ“‘NH3ΒΡΧεΜΐΖ÷ ΐ=![]() =
=![]() Θ§
Θ§
ΔΎ÷–Φ”»κΒΡΑ±ΤχΉΣΜ·≥…ΒΣΤχΚΆ«βΤχΚσΘ§ΒΣΤχΚΆ«βΤχΒΡΝΩ”κΔΌœύΆ§Θ§¥οΒΫΒΡΤΫΚβΉ¥Χ§Β»–ßΘ§“ρ¥ΥΤΫΚβ ±ΝΫΗω»ίΤς÷–Α±ΤχΒΡΧεΜΐΖ÷ ΐœύΒ»Θ§ΕΦ «![]() Θ§Bœν’ΐ»ΖΘΜ
Θ§Bœν’ΐ»ΖΘΜ
C. ΔΎ÷–Κ§”–0.2molNH3Θ§œύΒ±”Ύ‘ΎΔΌΒΡΜυ¥Γ…œΦ”»κΝΥΑ±ΤχΘ§“÷÷ΤΝΥΤΫΚβΒΡ’ΐœρ“ΤΕ·Θ§»ίΤςΔΎ÷–¥οΤΫΚβ ±Ζ≈≥ωΒΡ»»ΝΩQ<23.15 kJΘ§Cœν¥μΈσΘΜ
D. »τ»ίΤςΔΌΒΡΧεΜΐΈΣ0.5 LΘ§Φθ–Γ―Ι«ΩΘ§ΤΫΚβΡφœρ“ΤΕ·Θ§Ζ¥”ΠΈοΒΡΉΣΜ·¬ ΫΒΒΆΘ§¥οΒΫΤΫΚβ ±Ζ≈≥ωΒΡ»»ΝΩ–Γ”Ύ23.15 kJΘ§Dœν’ΐ»ΖΘΜ
¥πΑΗ―ΓCΓΘ


 Οϊ–ΘΩΈΧΟœΒΝ–¥πΑΗ
Οϊ–ΘΩΈΧΟœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœύΆ§Έ¬Ε»œ¬Θ§ΧεΜΐΨυΈΣ0.25LΒΡΝΫΗωΚψ»ίΟή±’»ίΤς÷–ΖΔ…ζΩ…ΡφΖ¥”ΠΘΚX2(g) + 3Y2(g) ![]() 2XY3(g) ΓςHΘΫΘ≠92.6kJ/mol
2XY3(g) ΓςHΘΫΘ≠92.6kJ/mol
Β―ι≤βΒΟΖ¥”Π‘ΎΤπ ΦΓΔ¥οΒΫΤΫΚβ ±ΒΡ”–ΙΊ ΐΨί»γœ¬±μΥυ ΨΘΚ
»ίΤς ±ύΚ≈ | Τπ Φ ±ΗςΈο÷ Έο÷ ΒΡΝΩ/mol | ¥οΤΫΚβ ±ΧεœΒΡήΝΩΒΡ±δΜ· | ||
X2 | Y2 | XY3 | ||
ΔΌ | 1 | 3 | 0 | 23.15 kJ |
ΔΎ | 0.6 | 1.8 | 0.8 | Q kJ |
œ¬Ν––π ω’ΐ»ΖΒΡ «
A. »ίΤςΔΌΓΔΔΎ÷–Ζ¥”ΠΒΡΤΫΚβ≥Θ ΐ≤ΜœύΒ»
B. ¥οΤΫΚβ ±Θ§ΝΫΗω»ίΤς÷–XY3ΒΡΈο÷ ΒΡΝΩ≈®Ε»ΨυΈΣ2 mol/L
C. »ίΤςΔΎ÷–Ζ¥”Π¥οΒΫΤΫΚβ ±Ζ≈≥ωΒΡ»»ΝΩΈΣ23.15kJ
D. »τ»ίΤςΔΌΧεΜΐΈΣ0.20 LΘ§‘ρ¥οΤΫΚβ ±Ζ≈≥ωΒΡ»»ΝΩ–Γ”Ύ23.15 kJ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩXΓΔYΓΔZΓΔW”–»γΆΦΥυ ΨΒΡΉΣΜ·ΙΊœΒΘ®Ζ¥”ΠΧθΦΰΚΆ≤ΩΖ÷ΤδΥϋΖ¥”ΠΈο Γ¬‘Θ© ‘ρXΓΔYΓΔZΩ…Ρή «Θ® Θ©

ΔΌNaΓΔNa2OΓΔNa2O2 ΔΎAlCl3ΓΔAlΘ®OHΘ©3ΓΔ NaA1O2
Δέ FeΓΔ FeCl2ΓΔFeCl3 ΔήNaOHΓΔNa2CO3 ΓΔNaHCO3 ΔίCΓΔCOΓΔCO2
A.ΔΌΔΎΔήΔίB.ΔΌΔέΔίC.ΔΎΔήD.ΔΌΔΎΔέΔήΔί
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“ΜΕ®Έ¬Ε»œ¬Θ§‘Ύ2LΒΡΟή±’»ίΤς÷–,MΓΔN ΝΫ÷÷ΤχΧεΒΡΈο÷ ΒΡΝΩΥφ ±Φδ±δΜ·ΒΡ«ζœΏ»γΆΦΥυ Ψ:

(1)Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ_______________ΓΘ
(2)Ζ¥”Π¥οΒΫΉν¥σœόΕ»ΒΡ ±Φδ «______minΘ§ΗΟ ±ΦδΡΎΒΡΤΫΨυΖ¥”ΠΥΌ¬ v(N)=______ΓΘ
(3)Ζ¥”Π¥οΒΫΤΫΚβΉ¥Χ§ ±Θ§Ζ≈÷–6QkJΒΡ»»ΝΩΘ§Β±»ίΤς÷–≥δ»κlmolNΘ§Ζ¥”ΠΖ≈≥ωΒΡ»»ΝΩΈΣ_____ΓΘ
ΔΌΒ»”ΎQkJ ΔΎ–Γ”ΎQkJ Δέ¥σ”ΎQkJ ΔήΒ»”Ύ2QkJ
(4)≈–ΕœΗΟΖ¥”Π¥οΒΫΤΫΚβΉ¥Χ§ΒΡ“άΨί «__________ΓΘ
ΔΌΗΟΧθΦΰœ¬Θ§’ΐΡφΖ¥”ΠΥΌ¬ ΕΦΈΣΝψ
ΔΎΗΟΧθΦΰœ¬Θ§ΜλΚœΤχΧεΒΡΟήΕ»≤Μ‘ΌΖΔ…ζ±δΜ·
ΔέΗΟΧθΦΰœ¬Θ§ΜλΚœΤχΧεΒΡ―Ι«Ω≤Μ‘ΌΖΔ…ζ±δΜ·
ΔήΗΟΧθΦΰœ¬Θ§ΒΞΈΜ ±ΦδΡΎœϊΚΡ2molNΒΡΆ§ ±Θ§…ζ≥…1molM
(5)ΡήΡήΦ”ΩλΖ¥”ΠΥΌ¬ ΒΡ¥κ © «_________ΓΘ
ΔΌ…ΐΗΏΈ¬Ε» ΔΎ»ίΤςΧεΜΐ≤Μ±δΘ§≥δ»κΥε–‘ΤχΧεAr
Δέ»ίΤς―Ιèä≤Μ±δΘ§≥δ»κΕη–‘ΤχΧεAr Δή Ι”Ο¥ΏΜ·ΦΝ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΈΣΧΫΨΩ Β―ι “÷Τ““œ©ΦΑ““œ©ΚΆδεΥ°ΒΡΦ”≥…Ζ¥”ΠΓΘΦΉΆ§―ß…ηΦΤΝΥ»γΆΦΥυ ΨΒΡ Β―ιΉΑ÷ΟΘ§≤ΔΫχ––ΝΥ Β―ιΓΘΒ±Έ¬Ε»…ΐ÷Ν170ΓφΉσ”“ ±Θ§”–¥σΝΩΤχΧε≤ζ…ζΘ§≤ζ…ζΒΡΤχΧεΆ®»κδεΥ°÷–Θ§δεΥ°ΒΡ―’…Ϊ―ΗΥΌΆ »ΞΓΘΦΉΆ§―ß»œΈΣ¥οΒΫΝΥ Β―ιΡΩΒΡΓΘ
““Ά§―ßΉ–œΗΩΦ≤λΝΥΦΉΆ§―ßΒΡ’ϊΗω Β―ιΙΐ≥ΧΘ§ΖΔœ÷Β±Έ¬Ε»…ΐΒΫ100ΓφΉσ ”“ ±Θ§Έό…Ϊ“ΚΧεΩΣ Φ±δ…ΪΘ§ΒΫ160ΓφΉσ”“ ±Θ§ΜλΚœ“Κ»Ϊ≥ ΚΎ…ΪΘ§‘Ύ170Γφ≥§ΙΐΚσ…ζ≥…ΤχΧεΥΌΕ»Οςœ‘Φ”ΩλΘ§…ζ≥…ΒΡΤχΧε”–¥ΧΦΛ–‘ΤχΈΕΓΘ”…¥ΥΥϊΆΤ≥ωΘ§≤ζ…ζΒΡΤχΧε÷–”Π”–‘”÷ Θ§Ω…Ρή”Αœλ““œ©ΒΡΦλ≥ωΘ§±Ί–κ≥ΐ»ΞΓΘΨί¥ΥΜΊ¥πœ¬Ν–Έ ΧβΘΚ

(1)–¥≥ωΦΉΆ§―ß Β―ι÷–ΝΫΗωΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΘΚ_____________ΓΔ___________________________ΓΘ
(2)““Ά§―ßΙέ≤λΒΫΒΡΚΎ…ΪΈο÷ «_____________Θ§¥ΧΦΛ–‘ΤχΧε «_____________ΓΘ““Ά§―ß»œΈΣ¥ΧΦΛ–‘ΤχΧεΒΡ¥φ‘ΎΨΆ≤ΜΡή»œΈΣδεΥ°Ά …Ϊ «““œ©ΒΡΦ”≥…Ζ¥”Π‘λ≥…ΒΡΓΘ‘≠“ρ «(”ΟΜ·―ßΖΫ≥Χ±μ Ψ)ΘΚ________ΓΘ
(3)±ϊΆ§―ßΗυΨίΦΉ““Ά§―ßΒΡΖ÷ΈωΘ§»œΈΣΜΙΩ…Ρή”–COΓΔCO2ΝΫ÷÷ΤχΧε≤ζ…ζΓΘΈΣ÷ΛΟςCO¥φ‘ΎΘ§Υϊ…ηΦΤΝΥ»γœ¬Ιΐ≥Χ(ΗΟΙΐ≥ΧΩ…Α― Β―ι÷–≤ζ…ζΒΡ”–Μζ≤ζΈο≥ΐΨΜ)ΘΚΖΔœ÷ΉνΚσΤχΧεΨ≠Βψ»Φ «άΕ…ΪΜπ―φΘ§»Ζ»œ”–“Μ―θΜ·ΧΦΓΘ

ΔΌ…ηΦΤΉΑ÷ΟaΒΡΉς”Ο «____________________
ΔΎ≈®δεΥ°ΒΡΉς”Ο «_______________________Θ§œΓδεΥ°ΒΡΉς”Ο «____________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–“άΨί»»Μ·―ßΖΫ≥Χ ΫΒΟ≥ωΒΡΫα¬έ’ΐ»ΖΒΡ «
A.“―÷ΣNaOHΘ®aqΘ©+HClΘ®aqΘ©=![]()
![]() H=-57.3
H=-57.3![]() ‘ρΚ§40.0 g NaOHΒΡœΓ»ή“Κ”κœΓ¥ΉΥαΆξ»Ϊ÷–ΚΆ,Ζ≈≥ω–Γ”Ύ57Θ°3 kJΒΡ»»ΝΩ
‘ρΚ§40.0 g NaOHΒΡœΓ»ή“Κ”κœΓ¥ΉΥαΆξ»Ϊ÷–ΚΆ,Ζ≈≥ω–Γ”Ύ57Θ°3 kJΒΡ»»ΝΩ
B.“―÷Σ2H2(g)+O2(g)=2H2O(g) ![]() H=-483.6
H=-483.6![]()
![]() ‘ρ«βΤχΒΡ»Φ…’»»ΈΣ241.8
‘ρ«βΤχΒΡ»Φ…’»»ΈΣ241.8![]()
C.“―÷Σ![]() =
=![]()
![]() H=a
H=a![]()
![]() ===2COΘ®gΘ©
===2COΘ®gΘ©![]() H=b
H=b![]() ‘ρa>b
‘ρa>b
D.“―÷ΣPΘ®ΑΉΝΉ,sΘ©=PΘ®ΚλΝΉ,sΘ©![]() H<0,‘ρΑΉΝΉ±»ΚλΝΉΈ»Ε®
H<0,‘ρΑΉΝΉ±»ΚλΝΉΈ»Ε®
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ…ηNAΈΣΑΔΖϋΦ”Β¬¬ό≥Θ ΐΒΡ÷ΒΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «( )
A.1 mol![]() ÷–Κ§”–ΒΡΧΦΧΦΥΪΦϋ ΐΈΣ4NA
÷–Κ§”–ΒΡΧΦΧΦΥΪΦϋ ΐΈΣ4NA
B.1 L 0.1mol/L NH4Cl»ή“Κ÷–Κ§”–NH![]() ΒΡ ΐΡΩΈΣ0.1NA
ΒΡ ΐΡΩΈΣ0.1NA
C.6.2gΑΉΝΉΖ÷Ή”÷–Κ§P-PΦϋΈΣ0.2 NA
D.7.8gNa2O2ΚΆNa2SΒΡΙΧΧεΜλΚœΈο÷–Κ§”–ΒΡάκΉ”Ήή ΐΈΣ0.3NA
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΈΣΧΫΨΩΡ≥Μ·ΚœΈοX (Κ§ΝΫ÷÷ΕΧ÷ήΤΎ‘ΣΥΊΘ§œύΆ§ΧθΦΰœ¬Θ§XΒΡœύΕ‘Ζ÷Ή”÷ ΝΩ ««βΤχΒΡ83.5±Ε)ΒΡΉι≥…ΚΆ–‘÷ Θ§Ρ≥Μ·―ß–Υ»Λ–ΓΉι…ηΦΤΝΥ»γœ¬ Β―ιΘ§Ά§Έ¬Ά§―Ιœ¬≤βΒΟAΒΡΧεΜΐ «BΒΡΕΰ±ΕΘ§Τδ÷–ΤχΧεBΓΔCΈΣΒΞ÷ ΓΘ.
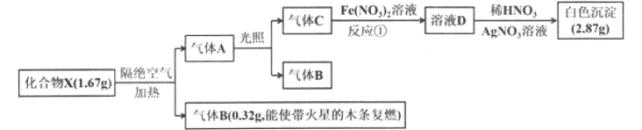
«κΜΊ¥πœ¬Ν–Έ Χβ:
(1)Μ·ΚœΈοXΒΡΜ·―ß ΫΈΣ______Θ§ ΤχΧεCΒΡΒγΉ” ΫΈΣ________
(2)Μ·ΚœΈοXΗτΨχΩ’Τχ ή»»Ζ÷ΫβΒΡΜ·―ßΖΫ≥Χ ΫΈΣ________ΓΘ
(3) Β―ι “≥Θ”Ο Σ»σΒΡKIΒμΖέ ‘÷ΫΦλ―ιΤχΧεCΘ§–¥≥ωάκΉ”ΖΫ≥Χ Ϋ_________ , œ÷œσ__________
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν– Β―ι ¬ Β≤ΜΡή”ΟΤΫΚβ“ΤΕ·‘≠άμΫβ ΆΒΡ «
A. 90 oCΘ§¥ΩΥ°ΒΡpH<7
B. ΜΤ¬Χ…ΪΒΡ¬»Υ°Ιβ’’Κσ―’…Ϊ±δ«≥
C. «βΤχΓΔΒβ’τΤχΓΔΒβΜ·«βΤχΧεΉι≥…ΒΡΤΫΚβΧεœΒΦ”―ΙΚσ―’…Ϊ±δ…ν
D. ÷ΊΗθΥαΦΊ»ή“Κ÷–ΒΈΦ”«β―θΜ·ΡΤ»ή“ΚΘ§»ή“Κ”…≥»…Ϊ±δΜΤ…Ϊ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com