
科目: 来源: 题型:
【题目】含MgCl2、AlCl3均为nmol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(离子(或物质)沉淀pH见表)
离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
开始沉淀时的pH | 8.93 | 3.56 | 开始溶解时的pH | 8.04 |
完全沉淀时的pH | 10.92 | 4.89 | 完全溶解时的pH | 12.04 |
A. 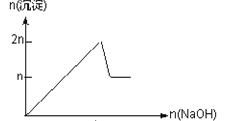
B. 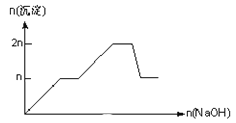
C. 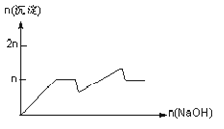
D. 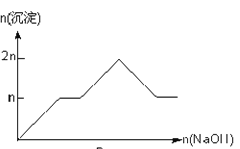
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:在圆底烧瓶中加入过量乙醇、浓硫酸和4.5g冰醋酸,再加入2~3片碎瓷片。开始缓慢加热圆底烧瓶,回流50分钟。待反应液冷至室温后,倒入分液漏斗中,依次用水、饱和Na2CO3溶液和水洗涤,分液后的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体。最后进行蒸馏,收集77~78℃馏分,得到乙酸乙酯产品5.28g。
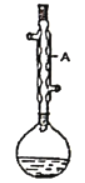
(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)仪器A的名称是________
(2)在烧瓶中加入乙醇和浓硫酸的先后顺序是_______
(3)在洗涤操作中,Na2CO3溶液洗涤的主要目的是_______
(4)本实验中,乙酸乙酯产品的产率为_____
查看答案和解析>>
科目: 来源: 题型:
【题目】原电池原理的发现极大地推进了现代化的进程,改变了人们的生活方式。关于下图所示原电池的说法 不正确的是 ( )
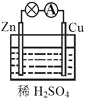
A.该装置将化学能转化为电能
B.反应一段时间后溶液的pH会增大
C.铜片上发生的反应是Cu2+ + 2e-=Cu
D.该装置使氧化反应和还原反应分别在两个不同的区域进行
查看答案和解析>>
科目: 来源: 题型:
【题目】淀粉常用于合成基础有机物的原料,某实验小组基于淀粉的水解设计了如下合成路线。
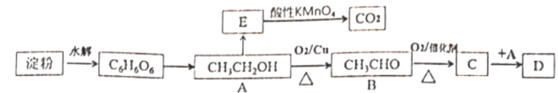
其中:E是最简单的烯烃,D是具有水果香味的物质。
(1) E的结构简式为_____
(2) C中的官能团名称是____
(3)写出A→B的化学方程式___________, 反应类型为________
(4)写出C→D的化学方程式___________,反应类型为_________
(5)要证明淀粉已经彻底水解,选择的检验试剂是_____
(6) E→CO2反应中,MnO![]() 被还原为Mn2+,写出反应的离子方程式_______
被还原为Mn2+,写出反应的离子方程式_______
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:

实验室用干燥而纯浄的二氧化硫和氯气合成硫酰氯,反应的热化学方程式为:SO2(g)+Cl2(g)![]() SO2Cl2(l) △H=-97.3 kJ· mol-1
SO2Cl2(l) △H=-97.3 kJ· mol-1
反应装置如图所示(夹持仪器已省略),请回答有关问题:

(1)仪器B的名称为________;
(2)仪器A的作用是_______;
(3)装置乙中盛放的试剂为______,在实验室用氢氧化钠溶液吸收多余硫酰氯的离子反应方程式为______;
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_______(填序号);
①先通冷凝水,再通气体 ②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①分解产物中分离出硫酰氯的实验操作名称为____。
②某同学为检验硫酰氯产品中是否混有硫酸设计实验如下:取少量产品溶于水,加入盐酸酸化的氯化钡溶液,振荡,观察到有白色沉淀生成,则认为产品中含有硫酸。该同学的结论是否正确,请说明理由____。
查看答案和解析>>
科目: 来源: 题型:
【题目】固体混合物X可能含有NaNO2、Na2SiO3、FeCl3、KAlO2中的一种或几种物质,某同学对该固体进行了如下实验:
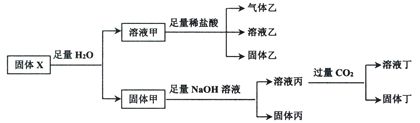
下列判断正确的是
A.溶液甲中一定含有NaNO2、Na2SiO3,可能含有FeCl3、KAlO2
B.原固体混合物X中一定有KAlO2
C.固体乙、固体丁一定是纯净物
D.将溶液乙和溶液丁混合一定有无色气体生成,可能有白色沉淀生成
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A.将Ca(HCO3)2溶液与少量Ca(OH)2溶液混合:Ca2+ +OH + HCO3 = CaCO3↓+ H2O
B.向Ba(NO3)2溶液中通入SO2气体,出现白色沉淀:SO2+H2O+Ba2+ = BaSO3↓+ 2H+
C.碳酸钙溶于醋酸:CaCO3 + 2H+ = Ca2+ + CO2↑+ H2O
D.往苯酚钠溶液中通入少量CO2:2![]() +CO2+H2O2
+CO2+H2O2![]() +CO32
+CO32
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式中,属于水解反应的是( )
A.HS- + H2O![]() H3O+ + S2-B.CO2 + 2H2O
H3O+ + S2-B.CO2 + 2H2O![]() HCO3- + H3O+
HCO3- + H3O+
C.NH4++H2O![]() NH3H2O + H+D.HCO3- + OH-
NH3H2O + H+D.HCO3- + OH-![]() CO32- + H2O
CO32- + H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是 ( )
A.水的电离方程式:H2O = H++OH-B.pH=7的溶液一定是中性溶液
C.升高温度,水的电离程度增大D.将稀醋酸加水稀释时,溶液中所有离子浓度均减小
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com