
科目: 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如表:
元素代号 | X | Y | Z | W | Q |
原子半径 | 160 | 143 | 70 | 66 | 104 |
主要化合价 |
|
|
|
|
|
下列选项正确的是( )
A.X、Y元素的金属性![]()
B.一定条件下,Z单质与W的常见单质直接生成![]()
C.Y的最高价氧化物对应的水化物能溶于氨水
D.Q与W形成的一种化合物可用作纸张漂白剂
查看答案和解析>>
科目: 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
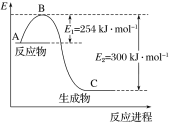
(1)上图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:______________。
(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:________ kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-a kJ·mol-1①
N2(g)+O2(g)===2NO(g) ΔH2=-b kJ·mol-1②
若1 mol NH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·mol-1(用含a、b的式子表示)。
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
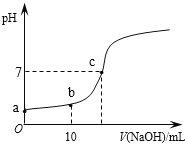
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中![]() 的值不断增大
的值不断增大
查看答案和解析>>
科目: 来源: 题型:
【题目】“84”消毒液(工业利用Cl2与NaOH反应制得)可用于消毒和漂白,下列实验现象的分析不正确的是
实验操作 |
|
|
|
实验现象 | 混合后溶液的pH=9.9,短时间内未褪色,一段时间后蓝色褪去。 | 混合后溶液pH=5.0,蓝色迅速褪去,无气体产生。 | 混合后溶液pH=3.2,蓝色迅速褪去,并产生大量气体,使湿润的淀粉碘化钾试纸变蓝。 |
A.对比实验①和②,②中蓝色迅速褪去的原因是发生了反应ClO+H+═HClO
B.实验③中产生的气体是Cl2,由HClO分解得到:2HClO═Cl2↑+H2O
C.对比实验②和③,溶液的pH可能会影响ClO的氧化性或Cl的还原性
D.加酸可以提高“84”消毒液的漂白效果,但需要调控合适的pH才能安全使用
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在体积恒定的密闭容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-QkJ·mol-1,下列说法正确的是( )
2NH3(g) ΔH=-QkJ·mol-1,下列说法正确的是( )
A.达到平衡时反应放出的热量可能达到QkJ
B.升高温度,逆反应速率减小
C.当混合气体的密度不再发生变化时,说明反应达到平衡状态
D.达到平衡时,v正(N2)=3v逆(H2)
查看答案和解析>>
科目: 来源: 题型:
【题目】下面两图均为原电池装置,有关说法错误的是( )
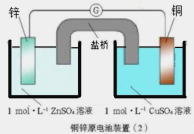
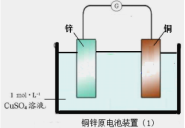
A.锌比铜活泼,锌为负极,发生氧化反应
B.电流从铜电极经导线流向锌电极
C.铜电极发生的反应为:Cu-2e-= Cu2+
D.装置(2)比装置(1)更能清楚揭示出电池中发生的化学反应
查看答案和解析>>
科目: 来源: 题型:
【题目】在BaSO4饱和溶液中加入少量的BaCl2溶液产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后溶液中
A.c(Ba2+)·c(SO42-)=Ksp,c(Ba2+)>c(SO42-)
B.c(Ba2+)=c(SO42-)=(Ksp)1/2
C.c(Ba2+)·c(SO42-)>Ksp,c(Ba2+)=c(SO42-)
D.c(Ba2+)·c(SO42-)≠Ksp,c(Ba2+)<c(SO42-)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,HA的电离常数Ka=1×10-6,向20 mL浓度为0.01 mol·L-1的HA溶液中逐滴加入0.01mol·L-1的NaOH溶液,溶液的pH与加入NaOH溶液的体积之间的关系如图所示,下列说法正确的是( )
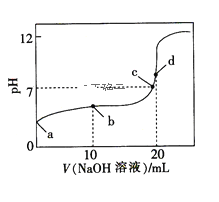
A.a点对应溶液的pH约为4,且溶液中只存在HA的电离平衡
B.b点对应溶液中:c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-)
C.d点对应溶液中:c(OH-)-c(H+)=c(A-)
D.a、b、c、d四点对应的溶液中水的电离程度:a<b<c<d
查看答案和解析>>
科目: 来源: 题型:
【题目】开发新能源和三废处理都是可持续发展的重要方面。
(1)由碳的氧化物直接合成乙醇燃料已进入大规模生产。如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
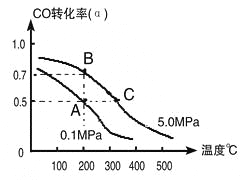
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K=_______;
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA____tC(填“大于”、“小于”或“等于”)。
③工业上还可以采取以CO2和H2为原料合成乙醇,并且更被化学工作者推崇,但是在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数。请推测化学工作者认可由CO2制取CH3CH2OH的优点主要是:_______________。
(2)目前工业上也可以用CO2来生产甲醇。一定条件下发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
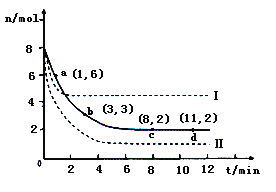
①请在答题卷图中绘出甲醇的物质的量随时间变化曲线_______。
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是_________,曲线Ⅱ对应的实验条件改变是_______。
(3)Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与Clˉ、OHˉ的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-1gc(Clˉ)]
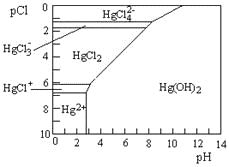
①下列说法中正确的是_____。
A.为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释
B.当c(C1ˉ)=10ˉ1mol·Lˉ1时,汞元素一定全部以HgCl42ˉ形式存在
C.HgCl2是一种弱电解质,其电离方程式是:HgCl2=HgCl++C1ˉ
D.当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2
②HgCl2又称“升汞”,熔点549K,加热能升华,其晶体是_____(填晶体类型)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是
A.Na2S的水解:S2-+ 2H2O![]() H2S + 2OH
H2S + 2OH
B.NaHCO3在水溶液中的电离:HCO3+ H2O![]() H2 CO3+ OH
H2 CO3+ OH
C.NH4Cl的水解:NH4+ + H2O![]() NH3·H2O + OH
NH3·H2O + OH
D.硫酸铝溶液和碳酸氢钠溶液混合: Al3+ + 3HCO3 = Al(OH)3↓+3CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com