
科目: 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A.甲酸钠溶液和盐酸反应:HCOO-+H+=HCOOH
B.硫化钠的第一步水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
C.醋酸钡溶液和硫酸反应:Ba2++SO42—=BaSO4↓
D.氢氧化钙溶液和碳酸氢镁反应:Ca2++OH-+HCO3-=CaCO3↓+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】H2C2O4是一种二元弱酸。常温下向H2C2O4溶液中滴加NaOH溶液,混合液中lgX随pH的变化关系如图所示。下列说法不正确的是( )
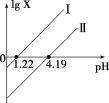
A.线Ⅰ中X表示的是![]()
B.线Ⅰ、Ⅱ的斜率均为1
C.c(HC2O42-) > c(C2O42-) > c(H2C2O4)对应溶液pH:1.22 < pH < 4.19
D.c(Na+)=c(HC2O4-)+2c(C2O42-)对应溶液的pH=7
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化氢一定条件下可发生分解:2H2O2(l)=2H2O(l)+O2(g),其能量变化如下图所示,下列说法正确的是
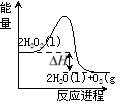
A.该分解反应为吸热反应
B.2molH2O2具有的能量小于2molH2O和1molO2所具有的总能量
C.加入MnO2或FeCl3均可提高该分解反应的速率
D.其他条件相同时,H2O2溶液的浓度越大,其分解速率越慢
查看答案和解析>>
科目: 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把含有大量![]() 的空气吹入
的空气吹入![]() 溶液中,再把
溶液中,再把![]() 从溶液中提取出来,并使之与
从溶液中提取出来,并使之与![]() 反应生成可再生能源甲醇。其工艺流程如图所示:
反应生成可再生能源甲醇。其工艺流程如图所示:

(1)分解池中主要物质是______;
(2)在合成塔中,若有![]() 与足量
与足量![]() 恰好完全反应,生成气态的水和甲醇,可放出5370kJ的热量,写出该反应的热化学方程式______;
恰好完全反应,生成气态的水和甲醇,可放出5370kJ的热量,写出该反应的热化学方程式______;
(3)该工艺在那些方面体现了“绿色自由”构想中的“绿色”______。(答二条)
(4)一定条件下,向2L恒容密闭容器中充入1mol![]() 和3mol
和3mol![]() ,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内
,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内![]() 的转化率随温度变化如图所示:
的转化率随温度变化如图所示:

![]() 图中c点的转化率为
图中c点的转化率为![]() ,即转化了
,即转化了![]()
①催化剂效果最佳的反应是______ (填“反应I”,“反应II”,“反应III”)。
②b点v (正)______ v (逆)(填“>”,“<”,“=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是______。
④c点时该反应的平衡常数K=______。
⑤一定条件下,向2L恒容密闭的上述容器中再充入1mol![]() 和3mol
和3mol![]() ,达到新的化学平衡后,
,达到新的化学平衡后,![]() 的浓度较原平衡浓度______
的浓度较原平衡浓度______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
(5)科学家还研究了其它转化温室气体的方法,利用图所示装置可以将![]() 转化为气体燃料
转化为气体燃料![]() 该装置工作时,N电极的电极反应式为______。
该装置工作时,N电极的电极反应式为______。

查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,向等浓度的NaCl和Na2CrO4溶液中分别滴加AgNO3溶液(已知:Ag2CrO4为砖红色),平衡时溶液中相关离子浓度的关系如图所示。下列说法正确的是( )

A.L1为向Na2CrO4溶液中滴加AgNO3溶液时的离子浓度关系曲线
B.Ksp(AgCl)的数量级为10-12
C.L1和L2交点处对应的两种溶液中c(Ag+)=c(Cl-)=c(CrO42-)
D.用AgNO3标准溶液测定溶液中Cl-含量时可用Na2CrO4做指示剂
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关金属的冶炼中,正确的是:
A.以海水为原料制得精盐,再电解精盐的水溶液制取钠
B.用海水、石灰乳等为原料,经一系列过程制得氧化镁,用H2还原氧化镁制得镁
C.以铁矿石、焦炭、空气等为原料,通过反应产生的CO在高温下还原铁矿石制得铁
D.用铝热法还原MnO2和Cr2O3,制得金属各1mol,消耗铝较少的是MnO2
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
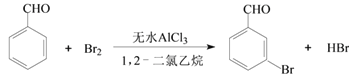
已知:①间溴苯甲醛温度过高时易被氧化。②溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点及相对分子质量见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
相对分子质量 | 160 | 106 | 185 |
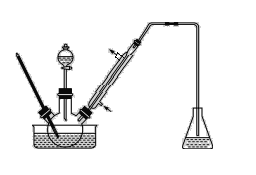
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出MgSO4nH2O晶体。
步骤4:分离有机层,收集相应馏分。
(1)实验装置中盛装液溴的仪器名称是_____,锥形瓶中的试剂为NaOH溶液其作用为________。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)___。
A.>229℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的___(填化学式)。
(4)步骤4中采用何种蒸馏方式_______,其目的是为了防止________。
(5)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在检验用FeCl3溶液生产铜制印刷线路板后所得的废液成分的实验中,下列根据实验现象得出的结论不正确的是( )
A.向混合液中加入过量的锌粉,过滤所得沉淀中含有两种金属
B.若向废液中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明废液中含有Cl-
C.若向废液中加少量铁粉,充分反应后无固体剩余,说明废液中含有Fe3+
D.若向废液中滴加KSCN 溶液,无现象,再加入氯水后溶液呈血红色,说明废液中含有Fe2+
查看答案和解析>>
科目: 来源: 题型:
【题目】毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
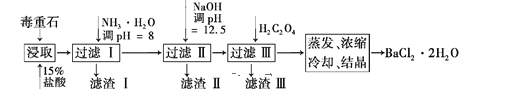
(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而_____________。
(2) 加入NH3·H2O调节pH=8可除去____(填离子符号),此时,溶液中该离子的浓度为______mol·L-1。再加入NaOH调pH=12.5,溶液内剩余的阳离子中______完全沉淀,____部分沉淀 (填离子符号)。加入H2C2O4时应避免过量,原因是____。已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9, Ksp[Fe(OH)3] =2.6×10-39。

(3由于Na2S2O5具有毒性,因此国家对其在食品中的用量有严格的规定。某化学兴趣小组在测定某白葡萄酒中Na2S2O5的残留量时,取40mL葡萄酒样品于锥形瓶中,滴入几滴淀粉溶液,用0.02 mol·L-1碘的标准溶液滴定至终点,消耗碘标准溶液5mL,则滴定终点的现象为__________,Na2S2O5的含量是以SO2来计算的,则该样品中Na2S2O5的残留量以![]() 计为______
计为______![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】用化学用语表示Na2CO3+2Cl2===2NaCl+Cl2O+CO2中的相关微粒,其中正确的是( )
A. Na+的结构示意图:![]()
B. Cl2O的结构式:Cl—O—Cl
C. 中子数比质子数多3的氯原子:3517Cl
D. CO2的电子式:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com