
【题目】下列有关金属的冶炼中,正确的是:
A.以海水为原料制得精盐,再电解精盐的水溶液制取钠
B.用海水、石灰乳等为原料,经一系列过程制得氧化镁,用H2还原氧化镁制得镁
C.以铁矿石、焦炭、空气等为原料,通过反应产生的CO在高温下还原铁矿石制得铁
D.用铝热法还原MnO2和Cr2O3,制得金属各1mol,消耗铝较少的是MnO2
科目:高中化学 来源: 题型:
【题目】已知NaHSO3溶液常温时显酸性,溶液中存在以下平衡:
HSO3-+H2O![]() H2SO3+OH- ①
H2SO3+OH- ①
HSO3-![]() H++SO32- ②
H++SO32- ②
向0.1mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
A.加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大
B.加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+c(SO32-)
C.加入氨水至中性,则2c(Na+)=c(SO32-)>c(H+)=c(OH-)
D.加入少量NaOH溶液,![]() 、
、![]() 的值均增大
的值均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,求下列溶液的pH(已知lg2=0.3)。
(1)0.1mol·L-1的CH3COOH溶液(已知CH3COOH的电离常数Ka=1.8×10-5)。
(2)0.1mol·L-1NH3·H2O溶液(NH3·H2O的电离度为α=1%,电离度=![]() ×100%)。
×100%)。
(3)将pH=8的NaOH与pH=10的NaOH溶液等体积混合。
(4)将pH=5的盐酸与pH=9的NaOH溶液以体积比11∶9混合。
则(1)pH=___;(2)pH=___;(3)pH=___;(4)pH=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y具有抗菌、消炎作用,可由X制得。
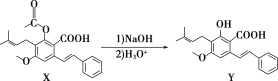
下列有关化合物X、Y的说法正确的是( )
A.1 mol X最多能与2 mol NaOH反应
B.Y与乙醇发生酯化反应可得到X
C.X、Y均能与酸性KMnO4溶液反应
D.室温下X、Y分别与足量Br2加成的产物分子中手性碳原子数目不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们对苯的认识有一个不断深化的过程。已知分子式为 C6H6的结构有多种,其中的两种为:
Ⅰ.![]() Ⅱ.
Ⅱ.
(1)这两种结构的化学性质区别表现在:Ⅰ不能____(填字母,下同),而Ⅱ能____。
A.被酸性KMnO4溶液氧化
B.与溴水发生加成反应
C.与氢气发生加成反应
(2)已知Ⅰ结构下,该物质能在一定条件下与液溴反应,其反应方程式为________________。
(3)今发现C6H6还可能有另一种如下图所示的立体结构,该结构的四氯代物有______种。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A.甲酸钠溶液和盐酸反应:HCOO-+H+=HCOOH
B.硫化钠的第一步水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
C.醋酸钡溶液和硫酸反应:Ba2++SO42—=BaSO4↓
D.氢氧化钙溶液和碳酸氢镁反应:Ca2++OH-+HCO3-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为 -69℃和58℃,写出该反应的热化学方程式___________。
(2)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9∶1,其电子式为______________。
(3)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价的含氧酸盐,消耗1.0L 2.2molL-1NaOH溶液和1.0molO2,则两种气体中相对分子质量小的气体物质的量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有可逆反应Fe(s)+CO2(g) ![]() FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)能判断该反应达到平衡状态的依据是_____(双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了
C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式_______。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=____(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。
①升高温度__________;②再通入CO___________。
(5)一氧化碳在工业上用途广泛,比如可以用来制备甲醇。甲醇是一种优质的液体燃料。利用甲醇,氧气,氢氧化钾溶液可以构成燃料电池。试写出该燃料电池的正极反应_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作的说法正确的是
A.实验时手指不小心沾上苯酚,立即用浓NaOH溶液清洗
B.用润湿的红色石蕊试纸置于试管口,试纸变蓝,证明有氨气产生
C.将氯化铝溶液加热蒸发,最后可得到氯化铝晶体
D.酸碱中和滴定时,锥形瓶需用待测液润洗后,再加入待测液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com