
【题目】已知NaHSO3溶液常温时显酸性,溶液中存在以下平衡:
HSO3-+H2O![]() H2SO3+OH- ①
H2SO3+OH- ①
HSO3-![]() H++SO32- ②
H++SO32- ②
向0.1mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
A.加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大
B.加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+c(SO32-)
C.加入氨水至中性,则2c(Na+)=c(SO32-)>c(H+)=c(OH-)
D.加入少量NaOH溶液,![]() 、
、![]() 的值均增大
的值均增大
科目:高中化学 来源: 题型:
【题目】在一定温度下,石灰乳达到平衡:Ca(OH)2 (s)![]() Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
A.加水,Ca(OH)2 溶解平衡向右移动,pH 增大
B.加入少量盐酸,Ca(OH)2 溶解平衡向右移动,ksp﹝Ca(OH)2﹞增大
C.加入少量氢氧化钠固体,Ca(OH)2 溶解平衡向左移动,溶液中 c(H+)减小
D.升高温度,Ca(OH)2 溶解平衡向右移动,ksp﹝Ca(OH)2﹞增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当下列物理量不再随时间变化时,表明反A(s)+2B(g)![]() C(g)+D(g)一定达到平衡状态的是
C(g)+D(g)一定达到平衡状态的是
A.混合气体的压强B.混合气体的密度
C.混合气体的物质的量D.混合气体中C和D的物质的量之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述不正确的是( )。
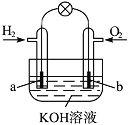
A.氢氧燃料电池是一种具有应用前景的绿色电源
B.a极是负极,该电极上发生氧化反应
C.总反应方程式为2H2+O2=2H2O
D.b极反应是O2+4OH--4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为_____________________。
(2)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
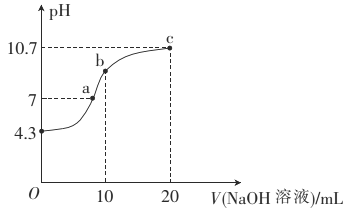
①写出H2N2O2在水溶液中的电离方程式:______________。
②b点时溶液中c(H2N2O2)_____(填“>”、“<”或 “=”,下同)c(N2O22-)。
③a点时溶液中c(Na+)____c(HN2O2-)+c(N2O22-)。
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中![]() =______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
=______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 时下列物质的溶度积
时下列物质的溶度积![]() 单位略
单位略![]() 。
。
| AgCl |
|
| |
|
|
|
|
|
下列说法正确的是![]()
A.等体积、浓度均为![]() 的
的![]() 和
和![]() 溶液混合能产生沉淀
溶液混合能产生沉淀
B.向含有浓度均为![]() 的
的![]() 和
和![]() 的溶液中慢慢滴入
的溶液中慢慢滴入![]() 溶液时,
溶液时,![]() 先沉淀
先沉淀
C.在![]() 悬浊液中加入盐酸时发生反应的离子方程式为
悬浊液中加入盐酸时发生反应的离子方程式为![]()
D.![]() 时,上述四种饱和溶液的物质的量浓度:
时,上述四种饱和溶液的物质的量浓度: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g)反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6mol,C的物质的量为0.8 mol。
2C(g)+2D(g)反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6mol,C的物质的量为0.8 mol。
(1)用C表示10 s内反应的平均反应速率为________。
(2)反应前A的物质的量浓度是________ mol·L-1 。
(3)10 s末,生成物D的物质的量浓度为____ mol·L-1。
(4)A与B的平衡转化率之比为________。
(5)反应过程中容器内气体的平均相对分子质量变化是________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=________。
(2)丙溶液中存在的电离平衡为______________(用电离平衡方程式表示)。
(3)常温下,用水稀释0.1 mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是________(填序号)。
①n(H+) ②c(H+) ③ c(CH3COOH)/c(CH3COO-) ④c(OH-)
(4)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为___________。
(5)某同学用甲溶液分别滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如图所示的两条滴定曲线,请回答有关问题:
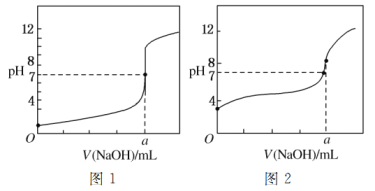
①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”)曲线。
②a=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的冶炼中,正确的是:
A.以海水为原料制得精盐,再电解精盐的水溶液制取钠
B.用海水、石灰乳等为原料,经一系列过程制得氧化镁,用H2还原氧化镁制得镁
C.以铁矿石、焦炭、空气等为原料,通过反应产生的CO在高温下还原铁矿石制得铁
D.用铝热法还原MnO2和Cr2O3,制得金属各1mol,消耗铝较少的是MnO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com