
科目: 来源: 题型:
【题目】下列平衡体系中,升温或减压都能使平衡向正反应方向移动的是( )
A. N2(g)+3H2(g)![]() 2NH3(g) ΔH <0
2NH3(g) ΔH <0
B. N2(g)+O2(g)![]() 2NO(g) ΔH <0
2NO(g) ΔH <0
C. C(s)+2H2O(g)![]() CO2(g)+2H2(g) ΔH >0
CO2(g)+2H2(g) ΔH >0
D. 2SO2(g)+O2(g)![]() 2SO3(g) ΔH <0
2SO3(g) ΔH <0
查看答案和解析>>
科目: 来源: 题型:
【题目】硼泥主要由MgO和SiO2组成,含有少量的Fe2O3,FeO、Al2O3等杂质。用硼泥生产氢氧化镁的工艺流程如图所示:
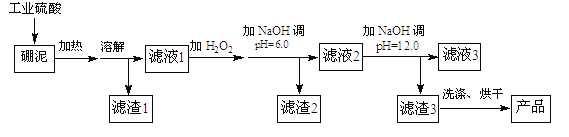
已知某些氢氧化物沉淀的PH如下表所示:
氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
Mg(OH)2 | 9.3 | 10.8 |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.7 | 4.7 |
(1)MgO的电子式为____。
(2)滤渣2的主要成分是 ____,向滤渣2中继续加入过量的NaOH溶液,发生的离子方程式为______。
(3)加入NaOH调节pH=12.0时,发生的离子方程式为___________。
(4)利用Mg(OH)2与含SO2的烟气反应生成MgSO4,可以使烟气脱硫,该反应的化学方程式为______。
(5)若取a吨硼泥为原料,最后得到b吨Mg(OH)2产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为__(用含有a、b的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g) + B(g)xC(g) + 2D(g),经4min后,测得D的浓度为0.4mol/L,c(A)︰c(B)=3︰5,C的平均反应速率是0.1 mol·(L ·min) -1。下列说法错误的是
A.A在4min末的浓度是0.6mol/LB.B在4min内的平均反应速率0.05 mol.L -1·min -1
C.x值是1D.起始时物质A的浓度为2.4mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,反应2HI(g)![]() H2(g)+ I2(g)(正反应吸热)达到平衡时,要使混合气体的颜色加深,可采取的措施是: ①增大氢气的浓度 ②升高温度 ③降低温度 ④缩小体积 ⑤增大HI的浓度 ⑥减小压强
H2(g)+ I2(g)(正反应吸热)达到平衡时,要使混合气体的颜色加深,可采取的措施是: ①增大氢气的浓度 ②升高温度 ③降低温度 ④缩小体积 ⑤增大HI的浓度 ⑥减小压强
A. ①③⑥ B. ③⑤⑥ C. ①③⑤ D. ②④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组以CoCl26H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验:

①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1 mL c1 molL-1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2 molL-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
②氯的测定:准确称取样品X配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不在消失为终点(Ag2CrO4为砖红色)。 回答下列问题:
(1)装置中安全管的作用原理是___________________。
(2)用NaOH标准溶液滴定过剩的HCl时,一般选用的指示剂为___________。
(3)样品中氨的质量分数表达式为____________________。
(4)测定氯的过程中,使用棕色滴定管的原因是____________________。
(5)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为______。制备X的化学方程式为_____________。X的制备过程中温度不能过高的原因是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应A2+B2=2AB,断开1molA2中的化学键消耗的能量为Q1 kJ,断开1molB2中的化学键消耗的能量为Q2 kJ,生成1molAB中的化学键释放的能量为Q3kJ,则下列说法正确的是
A. 若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热
B. 若A2和B2的总能量之和小于生成的2AB的总能量,则反应放热
C. 若该反应为放热反应,则Q1+Q2<Q3
D. 若该反应为吸热反应,则Q1+Q2<Q3
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应A(g)+ 4B(g)![]() C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A. vA=0.15mol/(L·min) B. vB=0.6 mol/(L·min)
C. vC=0.4 mol/(L·min) D. vD=0.01 mol/(L·s)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示装置中,观察到电流计指针偏转;M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 锌 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
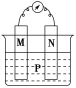
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述不正确的是( )
A.葡萄糖分子(HOCH2-CHOH-CHOH-CHOH-CHOH–CHO)中的手性碳原子数为4
B.氯化铯晶体中氯离子的配位数为8
C.![]() 的中心离子配位数为6
的中心离子配位数为6
D.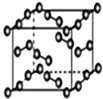 碘晶体中碘分子的排列方向种数为4
碘晶体中碘分子的排列方向种数为4
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述不正确的是![]()
A.金刚石、SiC、NaF、NaCl、![]() 、
、![]() 晶体的熔点依次降低
晶体的熔点依次降低
B.CaO晶体结构与NaCl晶体结构相似,CaO晶体中![]() 的配位数为6,且这些最邻近的
的配位数为6,且这些最邻近的![]() 围成正八面体
围成正八面体
C.设NaCl的摩尔质量为![]() ,NaCl的密度为
,NaCl的密度为![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]()
![]() ,在NaCl晶体中,两个距离最近的
,在NaCl晶体中,两个距离最近的![]() 中心间的距离为
中心间的距离为
D.X、Y可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角位置,则该晶体的化学式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com