
【题目】硼泥主要由MgO和SiO2组成,含有少量的Fe2O3,FeO、Al2O3等杂质。用硼泥生产氢氧化镁的工艺流程如图所示:
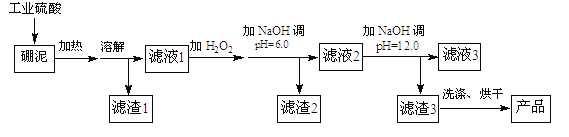
已知某些氢氧化物沉淀的PH如下表所示:
氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
Mg(OH)2 | 9.3 | 10.8 |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.7 | 4.7 |
(1)MgO的电子式为____。
(2)滤渣2的主要成分是 ____,向滤渣2中继续加入过量的NaOH溶液,发生的离子方程式为______。
(3)加入NaOH调节pH=12.0时,发生的离子方程式为___________。
(4)利用Mg(OH)2与含SO2的烟气反应生成MgSO4,可以使烟气脱硫,该反应的化学方程式为______。
(5)若取a吨硼泥为原料,最后得到b吨Mg(OH)2产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为__(用含有a、b的代数式表示)。
【答案】 Fe(OH)3、Al(OH)3 Al(OH)3+OH-=AlO2-+2H2O Mg2++2OH-=Mg(OH)2↓ 2Mg(OH)2+2SO2+O2=2MgSO4+2H2O
Fe(OH)3、Al(OH)3 Al(OH)3+OH-=AlO2-+2H2O Mg2++2OH-=Mg(OH)2↓ 2Mg(OH)2+2SO2+O2=2MgSO4+2H2O ![]()
【解析】
硼泥主要由MgO和SiO2组成,含有少量的Fe2O3,FeO、Al2O3,在硫酸的作用下,金属氧化物与酸反应,溶液中含有Mg2+、Fe3+、Fe2+、Al3+;SiO2不与酸反应,为滤渣1的主要成分。滤液1中加入H2O2,将Fe2+氧化成Fe3+,条件pH,使Fe3+和Al3+变成Fe(OH)3和Al(OH)3与镁离子分离。条件pH=12,Mg2+转变为Mg(OH)2,最后得到MgO。
(1)MgO是离子化合物,由Mg2+和O2-构成,电子式为![]() ;
;
(2)滤液1中含有Mg2+、Fe2+、Fe3+、Al3+等金属阳离子,加入双氧水,将Fe2+氧化成Fe3+;调节pH=6,根据表格中的数据,可知,Fe3+、Al3+沉淀完全,转化为Fe(OH)3、Al(OH)3;则滤渣2的主要成分是Fe(OH)3、Al(OH)3;继续加入过量的碱,Al(OH)3会溶于过量的碱,生成AlO2-,离子方程式为Al(OH)3+OH-=AlO2-+2H2O;
(3)滤液2中的金属离子主要包括Mg2+,根据表格中的数据,Mg2+在pH=12时,完全沉淀,因此加入NaOH调节pH=12,主要发生Mg2+沉淀的反应,离子方程式为Mg2++2OH-=Mg(OH)2↓;
(4)SO2中S的化合价为+4,而产物MgSO4中S的化合价为+6,说明发生了氧化还原反应,烟气中含有O2,1molO2转移4mol电子,需要2molSO2得到电子,则SO2和O2的比例为2:1,再根据物料守恒,有化学方程式为2Mg(OH)2+2SO2+O2=2MgSO4+2H2O;
(5)根据物料守恒,MgO~Mg(OH)2,生成b吨的Mg(OH)2需要MgO![]() 吨,则硼泥中MgO的质量分数为
吨,则硼泥中MgO的质量分数为![]() 。
。


科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如图。下列说法不正确的是( )

A. 在曲线上任一点均存在:c(Na+)c(OH-) = c(CH3COO-)c(H+)
B. 点①所示溶液中:c(CH3COO-)+2c(OH-) = c(CH3COOH)+2c(H+)
C. 点②所示溶液中:c(Na+) = c(CH3COO-)
D. 点③所示溶液中:c(Na+) > c(OH-) > c(CH3COO-) > c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们对苯的认识有一个不断深化的过程。已知分子式为 C6H6的结构有多种,其中的两种为:
Ⅰ.![]() Ⅱ.
Ⅱ.
(1)这两种结构的化学性质区别表现在:Ⅰ不能____(填字母,下同),而Ⅱ能____。
A.被酸性KMnO4溶液氧化
B.与溴水发生加成反应
C.与氢气发生加成反应
(2)已知Ⅰ结构下,该物质能在一定条件下与液溴反应,其反应方程式为________________。
(3)今发现C6H6还可能有另一种如下图所示的立体结构,该结构的四氯代物有______种。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为 -69℃和58℃,写出该反应的热化学方程式___________。
(2)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9∶1,其电子式为______________。
(3)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价的含氧酸盐,消耗1.0L 2.2molL-1NaOH溶液和1.0molO2,则两种气体中相对分子质量小的气体物质的量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+ 4B(g)![]() C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A. vA=0.15mol/(L·min) B. vB=0.6 mol/(L·min)
C. vC=0.4 mol/(L·min) D. vD=0.01 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有可逆反应Fe(s)+CO2(g) ![]() FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)能判断该反应达到平衡状态的依据是_____(双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了
C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式_______。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=____(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。
①升高温度__________;②再通入CO___________。
(5)一氧化碳在工业上用途广泛,比如可以用来制备甲醇。甲醇是一种优质的液体燃料。利用甲醇,氧气,氢氧化钾溶液可以构成燃料电池。试写出该燃料电池的正极反应_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl微溶于水,不溶于稀酸,可溶于Cl-浓度较大的体系,在潮湿的空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:

(1)基态铜原子核外电子排布式为:________。
(2)为了提高溶解速率,可以适当加热到60~70℃,还可以采用的措施为________。
(3)溶解步骤的温度控制在60~70℃,温度不宜过高的原因是________。该步骤中Cu 与NH4NO3反应的离子方程式为 (N元素被还原到最低价)_________________。
(4)还原步骤发生反应的离子方程式为______________________。
(5)滤液的主要成分为__________(写化学式)。
(6)酸洗时,可选用稀硫酸或稀盐酸,但不能用浓盐酸的原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.硫酸亚铁铵晶体要用冷水洗涤,而阿斯匹林过滤后则须用无水酒精洗涤
B.食醋总酸含量的测定实验中,若滴定终点没有控制好,即NaOH溶液滴加过量,则必须重做实验
C.火柴头中的氯元素检验的实验中,将火柴头![]() 未燃烧
未燃烧![]() 浸于水中,片刻后取少量溶液,加
浸于水中,片刻后取少量溶液,加![]() 溶液、稀硝酸,若出现白色沉淀,证明有氯元素
溶液、稀硝酸,若出现白色沉淀,证明有氯元素
D.毒物误入口内,可将![]() 稀硫酸铜溶液加入一杯温水中内服,人工促使呕吐出毒物后送医院
稀硫酸铜溶液加入一杯温水中内服,人工促使呕吐出毒物后送医院
查看答案和解析>>
科目:高中化学 来源: 题型:
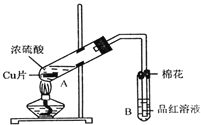
【题目】某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
(1)写出试管B中的实验现象______.
(2)写出A中反应的化学方程式______
(3)继续向A试管中加入![]() ,发现铜片溶解,反应的离子方程式为:______.
,发现铜片溶解,反应的离子方程式为:______.
(4)若仍不补充浓硫酸,只要求使铜片溶解,也可以加入![]() 填写两种属于不同类别物质的化学式
填写两种属于不同类别物质的化学式![]() ______、______.
______、______.
(5)![]() 试管口的棉花应沾有的试剂是______.
试管口的棉花应沾有的试剂是______.
小组成员向反应后的溶液中加入足量的氧化铜,使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却结晶制得硫酸铜晶体![]() 小组成员采用加热法测定该晶体里结晶水x的值.
小组成员采用加热法测定该晶体里结晶水x的值.
①在他们的实验操作中,至少称量______次;
②下面是其中一次实验的数据:
坩埚质量 | 坩埚与晶体的总质量 | 加热后坩埚与固体总质量 |
|
|
|
根据上表数据计算判断x的实测值比理论值![]() ______
______![]() 填“偏大”、“偏小”
填“偏大”、“偏小”![]() ,这次实验中产生误差的原因可能是______
,这次实验中产生误差的原因可能是______![]() 填序号
填序号![]()
A.硫酸铜晶体中含有不挥发的杂质![]() 实验前晶体表面有湿存水
实验前晶体表面有湿存水
C.加热时有晶体飞溅出去![]() 加热失水后露置在空气中冷却.
加热失水后露置在空气中冷却.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com