
科目: 来源: 题型:
【题目】常温下,某实验小组探究碳酸氢铵溶液中各微粒物质的量浓度随溶液pH的变化如图所示(忽略溶液体积变化),则下列说法错误的是( )
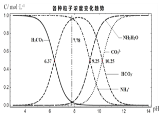
A.由图可知碳酸的Ka1数量级约为10-7
B.向NH4HCO3溶液加入与NH4HCO3等物质的量NaOH的溶液,HCO3-会先与NaOH反应
C.常温下将NH4HCO3固体溶于水,溶液显碱性
D.NH4HCO3作肥料时不能与草木灰混用
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )

A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在实验室中进行如图所示实验。
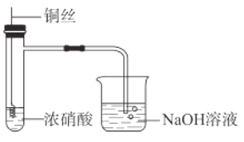
(1)铜丝与浓硝酸发生反应的离子方程式是________。
(2)烧杯中NaOH溶液的作用是________。
(3)铜丝下端弯成螺旋状的原因是________。
(4)根据反应产生的现象,从不同角度推断该反应所属反应类型:
①根据________现象,可推断该反应为氧化还原反应。
②根据反应后试管壁发热的现象,可推断该反应属于________反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
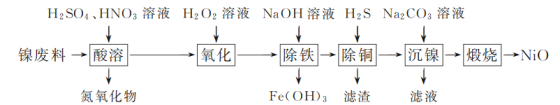
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是________。
(2) “氧化”时,Fe2+参加反应的离子方程式为________。
(3) “除铁”时需控制溶液的pH范围为________。
(4) “滤渣”的主要成分为________(填化学式)。
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨的催化氧化是工业制硝酸的基础。
(1)将氨的催化氧化反应的化学方程式补充完整:4NH3+5O2![]() ________。
________。
(2)氨的催化氧化反应说明氨具有________性(填“氧化”或“还原”)。
(3)除(2)中性质外,氨还具有________的化学性质,并列举一个氨表现该性质的反应;________(写出反应的化学方程式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表所示为元素周期表的短周期,其中除标出的元素外,表中的每个编号表示种元素。
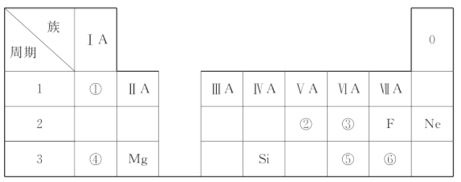
(1)④表示的元素是________(填元素符号)。
(2)②、③两种元素相比较,原子半径较大的是________(填元素符号)。
(3)①与⑥两种元素所形成化合物的电子式是________。
(4)元素的非金属性强弱比较:⑤________⑥(填“>”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式中,正确的是
A.铁片投入稀盐酸中:2Fe+6H+=2Fe3++3H2↑
B.稀硝酸滴在碳酸钙固体上:2H++![]() =H2O+CO2↑
=H2O+CO2↑
C.氯气通入氯化亚铁溶液中:Cl2+Fe2+=2Cl-+Fe3+
D.氯化钡溶液滴入硫酸钠溶液中:Ba2++![]() =BaSO4↓
=BaSO4↓
查看答案和解析>>
科目: 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是

A. 电流由O2所在的铂电极经外电路流向另一电极
B. O2所在的铂电极处发生还原反应
C. 该电池的负极反应式为:CH3CH2OH+3H2O-12e-="=" 2CO2↑+12H+
D. 微处理器通过检测电流大小而计算出被测气体中酒精的含量
查看答案和解析>>
科目: 来源: 题型:
【题目】依据如图判断,下列说法正确的是( )
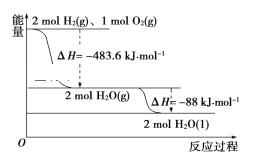
A. 氢气的燃烧热ΔH=-241.8 kJ·mol-1
B. 2 mol H2(g)与1mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低
C. 液态水分解的热化学方程式为2H2O(l)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com