
科目: 来源: 题型:
【题目】标准状况下,1.68L无色的可燃气体在足量氧气中完全燃烧。若将产物通入足量澄清石灰水中,得到白色沉淀质量为15g;若用足量碱石灰吸收燃烧产物,增重9.3g。
(1)燃烧产物中水的质量为_____g。
(2)若原气体是单一气体,则其分子式为_____,若将该气体设计成碱性(KOH)燃料电池,请写出负极反应式_____。
(3)若原气体是由两种等物质的量的气态烃组成的混合物,请写出它们的分子式________。(请写出两组)
(4)若原气体是由两种等物质的量的气体组成的混合物,其中只有一种是烃,请写出它们的分子式______。(请写出两组)
查看答案和解析>>
科目: 来源: 题型:
【题目】298K时,二元弱酸H2X溶液中含X微粒的分布分数如图所示。下列叙述正确的是
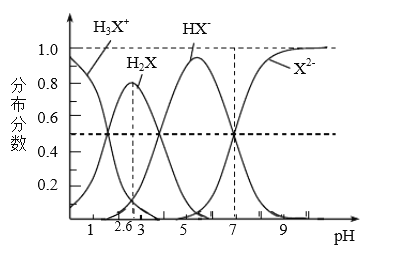
A. 溶液呈中性时: c(Na+)=2c(X2-)
B. Ka2(H2X)为10-7
C. NaHX溶液c( H+)< c(OH-)
D. 溶液pH由1开至2.6时主要存在的反应是: H2X +OH-=HX-+ H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验.
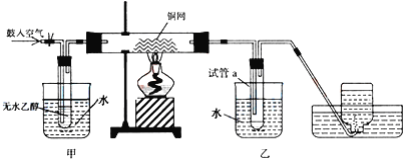
(1)仪器连接安装完毕,进行实验前如何检验装置的气密性:_____;
(2)实验过程中铜网出现的现象________;
(3)甲和乙两个水浴作用不相同.甲的作用是__;乙的作用是__;.
(4)反应进行一段时间后,试管a中能收集到不同的物质,它们是__,集气瓶中收集到的气体的主要成分是__;
(5) 若试管a中收集到的液用紫色石蕊试纸检验,试纸显红色,说明液体中还含有_____,要除去该物质,可先在混合液中加入______(填写字母),然后,再通过_____(填实验操作名称)即可除去。
a、氯化钠溶液 b、苯 c、碳酸氢钠溶液 d、四氯化碳
查看答案和解析>>
科目: 来源: 题型:
【题目】在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。下列判断不正确的是( )

A. 原上层液体可能是KI的水溶液,原下层液体可能是CCl4
B. 搅拌后两层液体颜色发生变化的原因是I2在CCl4中的溶解度大于在水中溶解度,所以绝大部分I2都转移到CCl4中
C. 阴极区域pH增大的原因是水分子得电子生成了OH—
D. 阳极上的电极反应式2H++2e - =H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)冬季是雾霾的高发季节,天气预报会及时发布PM2.5的污染警报。
①下列行为不会增加城市大气中PM2.5浓度的是______(填字母)。
a.燃放烟花爆竹 b.为城市主干道洒水保洁 c.露天焚烧落叶
②雾霾会刺激呼吸道,使人易患流行性感冒。感冒发烧病人可服用______(填字母)药品进行治疗。
a.补血剂 b.抗酸药 c.阿司匹林
③维生素C可增强人体的免疫力。维生素C具有的性质是______(填字母)。
a.还原性 b.常温下不溶于水 c.溶液显碱性
(2)著名物理化学家张存浩院士在氟化氢(氘)激光器和水煤气合成液体燃料研究等方面做出了重要贡献。
①氟化氢(HF)的水溶液能腐蚀玻璃。该反应的化学方程式为______,制备普通玻璃的主要原料有SiO2、CaCO3、______(填化学式)。
②水煤气的主要成分是CO和H2,在40 MPa、380 ℃、锌铬氧化物作催化剂的条件下,用CO和H2合成液体燃料CH3OH,该反应的化学方程式为______。
(3)海底考察、水底打捞中均需要进行潜水作业。
①一种简易潜水器是潜水钟,由钢铁制成,在海水中会发生______腐蚀,反应中得到电子的物质是______。
②潜水员需要均衡的膳食结构。糖类、油脂、蛋白质都能为人体提供能量。油脂在人体中发生水解生成甘油和______;蛋白质在酶的作用下水解生成______,而被人体吸收。
③考察活动中会产生大量废水和垃圾。含汞离子废水需要处理后再排放,加入适量的硫化钠溶液能使汞离子变成______(填化学式)沉淀而除去;随便丢弃聚乙烯塑料膜会造成白色污染,聚乙烯的结构简式是______;如图是贴在某垃圾桶上的标志,该标志的含义是______。

查看答案和解析>>
科目: 来源: 题型:
【题目】CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= -890.3 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用而产生的能量存活,甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量____________(填“>”、“<”或“=”)890.3 kJ。
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2= 2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,则:

①上图(所有物质均为气态)能表示该反应过程中能量变化的是__________(填字母)。
②若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随时间的变化如图所示,则CH4的转化率为 。
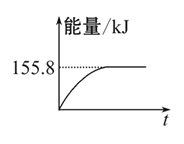
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)=CH4(g)的反应热ΔH= 。
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是_____________(填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.将固态碳合成为C60,以C60作为燃料
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A. 用排饱和氯化钠溶液的方法来收集氯气
B. 配制和保存硫酸铁溶液常加入适量稀硫酸
C. 向氢氧化镁悬浊液中加入饱和氯化铵溶液,溶液变澄清
D. 对2 HI (g)![]() H2 (g) + I2 (g)的平衡体系,增大压强使颜色变深
H2 (g) + I2 (g)的平衡体系,增大压强使颜色变深
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,在![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示
溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示![]() 因逸出未画出,忽略因气体逸出引起的溶液体积变化
因逸出未画出,忽略因气体逸出引起的溶液体积变化![]() ,下列说法正确的是
,下列说法正确的是![]()
![]()
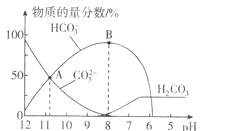
A.在![]() 溶液中:
溶液中:![]()
B.当溶液的pH为7时,溶液的总体积为![]()
C.在B点所示的溶液中,离子浓度最大的是![]()
D.在A点所示的溶液中:![]()
查看答案和解析>>
科目: 来源: 题型:
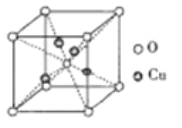
【题目】铜及其化合物有着十分重要的用途:如氨基乙酸铜[结构简式为(H2NCH2COO)2Cu]常用作食品补铜剂及矿物元素饲料添加剂,硒化铜纳米晶在光电转化中有着广泛地应用;硫酸铜可用作配制农药等。
(1)基态硒原子的电子排布式为____,基态氮原子电子的空间运动状态有__种,与硒同周期相邻的三种元素第一电离能由大到小的顺序为______
(2)(H2NCH2COO)2Cu氨基乙酸铜中,碳原子的杂化轨道类型是______;与氮原子成键的原子(含氮原子本身)形成的空间构型是__________。
(3)硫酸铜晶体的组成可表示为[Cu(H2O)4]SO4·H2O,实验测得该物质中存在氢键且水分子成“键”情况与冰中类似,则1mol[Cu(H2O)4]SO4·H2O中氢键数目为__NA。
(4)硫酸铜在高温下分解有可能得到CuO、Cu2O、SO2、SO3等物质,其中CuO的熔点为1026℃。
①CuO的晶体类型是_____,熔点Cu2O>Cu2S的原因是______
②SO2与SO3中,属于非极性分子的是__,SO2在溶剂水与溶剂CCl4中,相同温度能溶解更多SO2的溶剂是___________
③铜的某种氧化物的晶胞如下图所示,则该氧化物的化学式为_______,若组成粒子氧、铜的半径分别为rOpm、rCupm,密度ρg/cm3,阿伏加德罗常数值为NA,则该晶胞的空间利用率为______(用含π的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,由醋酸和醋酸钠按一定比例混合形成的溶液始终保持c(CH3COOH) +c(CH3COO-)= 0.1mol/L,该溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如下图所示,下列有关该溶液的叙述中正确的是
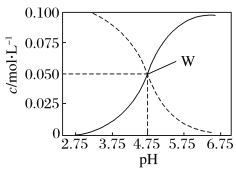
A.pH=5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W点所表示的溶液中:c(Na+)=c(CH3COOH)
C.pH=3的溶液中:c(H+)+c(Na+)+c(CH3COOH)=0.1mol/L
D.据图像可求得该温度下CH3COOH的电离常数Ka=10-4.75
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com