
科目: 来源: 题型:
【题目】一定温度下,在一个容积固定的密闭容器中有可逆反应 A2(g) + B2(g)![]() 2AB(g),达到平衡的标志是
2AB(g),达到平衡的标志是
A.容器内气体的总压强不随时间的变化而变化
B.单位时间内生成n mol A2同时就有2 n mol AB生成
C.容器内气体的密度不随时间的变化而变化
D.单位时间内有n mol B2生成同时就有n mol AB分解
查看答案和解析>>
科目: 来源: 题型:
【题目】已知水的电离平衡曲线如图所示:
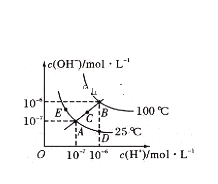
据图回答下列问题:
①图中A、B、C三点处![]() 的大小关系为____________________________________。
的大小关系为____________________________________。
②在A点处,温度不变时,往水中通入适量HCl气体,可以使体系从A点变化到________点。
③在B点处,0.01mol/L的NaOH溶液的pH=_______________。
④在B点处,0.5mol/L ![]() 溶液与1mol/L的KOH溶液等体积混合,充分反应后,所得溶液的pH=__________。
溶液与1mol/L的KOH溶液等体积混合,充分反应后,所得溶液的pH=__________。
⑤在A点处,1g水中含有H+的个数为___________,水的电离平衡常数K与水的离子积![]() 关系为________________。
关系为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol/LCuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,已知:lg2=0.3,Ksp(ZnS)=3×10-25 。下列有关说法正确的是( )

A.a、b、c三点中,水的电离程度最大的为b点
B.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C.该温度下Ksp(CuS)=4×10-36
D.向100 mL Zn2+、Cu2+浓度均为10-5 mol/L的混合溶液中逐滴加入10-4 mol/L的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】锰锌铁氧体是应用广泛的高性能磁性材料。现以akg废旧碱性锌锰电池为原料(含锰元素的物质:MnO2占b%,MnOOH占c%)制备锰锌铁氧体,主要流程如下:
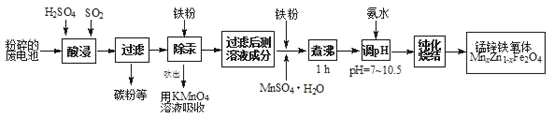
(1)酸浸废电池时,被溶解生成Zn2+的物质有______,SO2的作用是_____(填字母编号)。
A.漂白剂 | B.沉淀剂 | C.氧化剂 | D.还原剂 |
(2)除汞是以氮气为载体吹入滤液带出汞蒸汽,经KMnO4溶液吸收而实现的。如图是KMnO4溶液处于不同pH时对应的单位时间Hg去除率变化图,图中物质为Hg与MnO4-在该pH范围反应的主要产物。
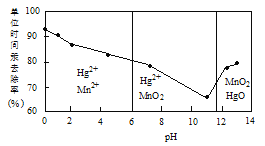
①pH<6时反应的离子方程式为___________。
②汞的去除速率随pH变化的规律是_________。
(3)锌锰干电池中MnO2可以用碳酸锰在空气中煅烧制得。
已知25℃,101 kPa时:2MnO(s)+O2(g)=2MnO2(s) H=-272.0 kJ/mol
MnCO3(s)=MnO(s)+CO2(g) H=+116.6 kJ/mol
碳酸锰在空气中煅烧反应生成MnO2的热化学方程式是_______________。
(4)x=0.2的锰锌铁氧体具有较高的饱和磁场强度,该锰锌铁氧体的组成用氧化物形式(最简整数比)表示为____________。若制得这种锰锌铁氧体的质量为100 kg,在制取过程中不考虑损耗,需补充硫酸锰晶体(MnSO4·H2O)_________kg。(只列出计算式)
查看答案和解析>>
科目: 来源: 题型:
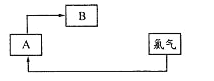
【题目】海水资源的开发和利用是当前科学研究的一项重要任务。下图是实验室模拟镁开发的流程图:
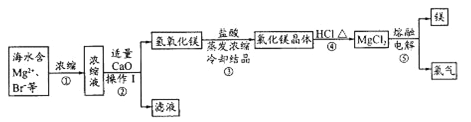
根据上述流程图,回答下列问题:
(1)操作I的名称是________。
(2)步骤中②反应的化学方程式为________。
(3)步骤④中加热时通入HCl气流的作用是__________。
(4)步骤⑤的离子反应方程式为___________。
(5)有人提出步骤⑤的副产物可在流程中再利用以提高海水的综合利用率。若A为上述流程中的某组分,则A、B分别为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下有H2RO4=H++HRO4-、HRO4-H++RO42-,现有物质的量浓度都为0.1molL-1的三种溶液:①NaHRO4溶液;②H2RO4溶液;③Na2RO4溶液。下列说法中正确的是( )
A.②和③等体积混合后的溶液中:c(Na+)=c(HRO4-)+c(H2RO4)+c(RO42-)
B.100mL①溶液中:n(HRO4-)+n(RO42-)+n(OH-) -n(H+)=0.01mol
C.①和②等体积混合后的溶液中离子浓度大小顺序为c(H+)>c(HRO4-)>c(Na+)
D.若①和③等体积混合后,会抑制水的电离,则HRO4-的电离程度肯定大于RO42-的水解程度
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度时,将1 mol A和2 mol B放入容积为5L的某密闭容器中发生如下反应:![]() ,经5min后,测得容器内B的浓度减少了
,经5min后,测得容器内B的浓度减少了![]() ,则下列叙述错误的是( )
,则下列叙述错误的是( )
A.在5 min内,该反应用C的浓度变化表示的反应速率为![]()
B.在5 min时,容器内D的浓度为![]()
C.该可逆反应未达限度前,随反应的进行,容器内压强逐渐增大
D.5 min时,容器内气体总的物质的量为3 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示:
酸 | 电离平衡常数 |
醋酸 |
|
碳酸 |
|
亚硫酸 |
|
①亚硫酸发生电离的方程式为____________________________________________。
②碳酸和亚硫酸的第一步电离程度大于第二步电离程度的原因:_____________________。
③在相同条件下,试比较![]() 、
、![]() 和
和![]() 的酸性强弱:_______> ______>_______。
的酸性强弱:_______> ______>_______。
④将pH=4的![]() 溶液稀释100倍后溶液的pH范围是______________________,图中的纵坐标可以是_______________________。
溶液稀释100倍后溶液的pH范围是______________________,图中的纵坐标可以是_______________________。
a.溶液的pH b.醋酸的电离平衡常数 c.溶液的导电能力 d.醋酸的电离程度
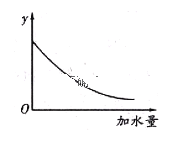
⑤若醋酸的初始浓度为0.01 mol/L,平衡时氢离子浓度是________________________(写出详细解题步骤)
⑥写出亚硫酸氢钠与碳酸钠反应的离子方程式_________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙三种烃分子的结构如图所示,下列有关说法错误的是( )
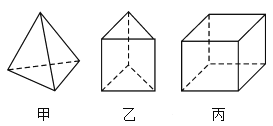
A.1 mol甲分子内含有10 mol共价键
B.由乙分子构成的物质不能发生氧化反应
C.丙分子的二氯取代产物只有三种
D.三者不互为同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】常温时,下列叙述正确的是![]()
A.![]() 的
的![]() 与
与![]() 混合溶液中
混合溶液中![]()
B.![]() 的可乐中
的可乐中![]() 是
是![]() 的柠檬水中
的柠檬水中![]() 的10倍
的10倍
C.AgCl在![]()
![]() 溶液和
溶液和![]() NaCl溶液中的溶解度相同
NaCl溶液中的溶解度相同
D.![]() 溶液加水稀释至100mL,pH和
溶液加水稀释至100mL,pH和![]() 均减小
均减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com