
科目: 来源: 题型:
【题目】反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液,一定呈中性的是
A. 由等体积、等物质的量浓度的硫酸跟NaOH溶液混合后所形成的溶液
B. c(H+)=1.0×10-7mol·L-1的溶液
C. pH=7的溶液
D. c(H+)=![]() 的溶液(Kw为该温度下水的离子积常数)
的溶液(Kw为该温度下水的离子积常数)
查看答案和解析>>
科目: 来源: 题型:
【题目】在体积为2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)。其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g)。其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________________。
(2)该反应为____________反应(选填吸热、放热),原因是_____________________。
(3)能判断该反应是否达到化学平衡状态的依据是________________(多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 _______________℃。该温度下,若向容器中分别加入2mol H2和2molCO2,10s后达到平衡,则这段时间内υ(H2)=_______________, CO2的转化率为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:

(1)钛铁矿在预处理时需要进行粉碎,其原因是___________________。
(2)过程①中反应的离子方程式是: FeTiO3 + 4H++ 4Cl-== Fe2+ + TiOCl42-+ 2H2O、_______。
(3)过程①中,铁的浸出率结果如图1所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是___________________。

(4)过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图2所示,反应温度过高时,Ti元素浸出率下降的原因是___________。
(5)在滤液B转化为FePO4沉淀过程中发生以下反应,请配平:
Fe2+ +_____ + H3PO4 ===FePO4 + ____ + _____
(6)过程③中由FePO4制备LiFePO4的化学方程式是_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】由菱镁矿(主要成分为MgCO3、CaCO3、FeCO3、SiO2)制备高纯Mg(OH)2的一种工艺如下:
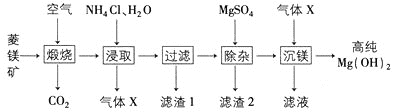
下列说法不正确的是
A.“煅烧”时FeCO3发生反应为4FeCO3+O2![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
B.“浸取”产生的气体X为NH3
C.“滤渣1”“滤渣2”分别为SiO2、CaSO4
D.“沉镁”所得的固体是否洗涤干净可用BaCl2溶液检验
查看答案和解析>>
科目: 来源: 题型:
【题目】NiSO4是制备磁性材料和催化剂的重要中间体。用含镍废料(主要成分为NiO,含有少量CuO、FeO和SiO2)制备NiSO4并回收金属资源的流程如图:
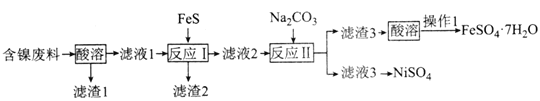
下列说法错误的是( )
A.“酸溶”时应选用硫酸
B.滤渣2的成分为CuS和FeS
C.“操作1”为蒸发结晶
D.合理处理废弃物有利于保护环境和资源再利用
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组为探究![]() 溶液和不同类型盐溶液反应的多样性,设计如图实验:
溶液和不同类型盐溶液反应的多样性,设计如图实验:

已知:AgSCN为白色难溶物。
下列说法不正确的是( )
A.①中的白色沉淀是![]()
B.向①的试管中滴加![]() KI溶液,有黄色沉淀生成证明存在
KI溶液,有黄色沉淀生成证明存在![]()
C.②中发生了氧化还原反应
D.对于③中红色褪去的原因可能与平衡移动原理有关
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如右图所示。下列说法正确的是

A.铁是阳极,电极反应为Fe-2e-+2OH-![]() Fe(OH)2
Fe(OH)2
B.电解一段时间后,镍电极附近溶液的pH减小
C.若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42-
D.每制得1mol Na2FeO4,理论上可以产生67.2L气体
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,三种酸的电离平衡常数如下表所示。
化学式 | CH3COOH | HClO | H3PO3 |
名称 | 醋酸 | 次氯酸 | 亚磷酸 |
电离平衡常数 | 1.8×10-5 | 3.0×10-8 | K1=8.3×10-3 K2 =5.6×10-6 |
回答下列问题:
(1)浓度均为0.1 molL-1的CH3COOH 、HClO 、H3PO3溶液中,c(H+)最小的是_____________。
(2)亚磷酸(H3PO3)为二元酸,具有较强的还原性。H3PO3的第二级电离方程式为________________。Na2HPO3是_____________(填“酸式盐”“碱式盐”或“正盐”)。
(3)常温下,0.1 molL-1的CH3COOH溶液加水稀释的过程中,下列表达式的数值变大的是______(填字母)。
A.c(H+) B.  C.c(CH3COO-) D.c(CH3COOH)
C.c(CH3COO-) D.c(CH3COOH)
(4)体积均为10mL、c(H+)均为10-2 mol L-1的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中c(H+)的变化如图所示,则HX的电离平衡常数_______________(填“大于”“ 小于”或“等于”)醋酸的电离平衡常数,理由是____________________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用 0.1000 mol·L![]() NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L![]()
![]() 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是

A.点①所示溶液中:![]()
B.点②所示溶液中:![]()
C.点③所示溶液中:![]()
D.滴定过程中可能出现:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com