
科目: 来源: 题型:
【题目】某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定烧碱的纯度,进行以下滴定操作:
A.在250mL容量瓶中定容成250mL烧碱溶液
B.用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴酚酞指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为M mol·L-1的标准HCl溶液装入酸式滴定管,调整液面,记下开始刻度数为V1mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点酸的体积V2mL
回答下列问题:
(1)正确的操作步骤的顺序是(用字母填写)________→________→________→D→________
(2)使用滴定管之前应进行的操作是________
(3)操作E中的锥形瓶下垫一张白纸的作用是________
(4)若酸式滴定管未用盐酸标准溶液润洗,会对测定结果有何影响________(填“偏高”、“偏低”或“无影响”)
(5)该烧碱样品的纯度计算式________
查看答案和解析>>
科目: 来源: 题型:
【题目】已知草酸为二元弱酸:H2C2O4![]() HC2O4-+ H+ Ka1; HC2O4-
HC2O4-+ H+ Ka1; HC2O4-![]() C2O42-+ H + Ka2,常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是()
C2O42-+ H + Ka2,常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是()
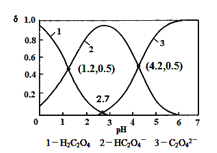
A.常温下,Ka1:Ka2=1000
B.将相同物质的量 KHC2O4和 K2C2O4固体完全溶于水可配得 pH 为 4.2 的混合液
C.pH=1.2溶液中:c(K +) + c(H +) = c(OH-) + c(H2C2O4)
D.向pH=1.2的溶液中加KOH 溶液将pH增大至4.2的过程中水的电离度一直增大
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.1molCu与足量稀HNO3反应,转移3NA个电子
B.常温常压下,22.4LCl2含有2NA个Cl原子
C.16gCH4含有10NA个电子
D.1L0.1mol/LNa2SO3溶液中含有0.1NA个SO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是![]()
A.工业制普通玻璃、工业炼铁的原料都需用到石灰石
B.接触法制硫酸工业中,![]() 转变为
转变为![]() 的反应在热交换器中进行
的反应在热交换器中进行
C.生物炼铜法是细菌利用氧气将硫化铜转化为硫酸铜,使铜的冶炼变得十分简单
D.电解饱和食盐水可制取氯气
查看答案和解析>>
科目: 来源: 题型:
【题目】研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。
(1)CO可用于合成甲醇。在体积可变的密闭容器中充入4molCO和8molH2,在催化剂作用下合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:
CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:

①该反应的逆反应属于________反应;(填“吸热”或“放热”)。
②在0.1Mpa 、100℃的条件下,该反应达到平衡时容器体积为开始容器体积的_________倍。(结果保留两位小数点)
③在温度和容积不变的情况下,再向平衡体系中充入4molCO,达到平衡时CO转化率________(填“增大”,“不变”或“减小”),平衡常数K________(填“增大”,“不变”或“减小”)。
(2)在反应(Ⅰ)中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
①CH4(g)+ H2O(g)= CO(g)+3H2(g) △H=+206.2 kJ·mol-1
②CH4(g)+ CO2(g)= 2CO(g)+2H2(g) △H=+247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为: 。
(3)在反应(Ⅰ)中制得的CH3OH 即可以做燃料,还可以与氧气组成碱性燃料电池,电解质溶液是20%~30%的KOH溶液。则该燃料电池放电时:负极的电极反应式为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | |||
CO | H2O | CO2 | H2 | |||
① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ |
② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q |
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量_____________(填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量。
(2)容器①中反应达平衡时,CO的转化率为_____________。
(3)计算容器①中反应的平衡常数K=_____________。某时刻测得②中氢气的物质的量为1.8mol,请问此刻V正 V逆(填大于,小于或等于)
(4)下列叙述正确的是_____________(填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q > 65.6 kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,两容器中CO的转化率相同
(5)已知:2H2(g)+O2(g)=2H2O(g)ΔH=-484kJ/mol,请写出CO完全燃烧生成CO2的热化学方程式: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,改变反应物中n(SO2),对反应2SO2(g)+O2(g)2SO3(g) ΔH<0的影响如图所示,下列说法正确的是( )
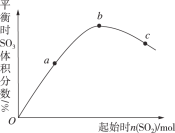
A.反应bc点均为平衡点,a点未达到平衡且向正反应方向进行
B.abc三点的平衡常数Kb>Kc>Ka
C.上述图象可以得出SO2的含量越高得到的混合气体中SO3的体积分数越高
D.abc三点中,a点时SO2的转化率最高
查看答案和解析>>
科目: 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g) ![]() 2C(g),达到平衡后,在不同的时间段内反应物的浓度随时间的变化如图甲所示,正逆反应速率随时间的变化如图乙所示,下列说法中正确的是( )
2C(g),达到平衡后,在不同的时间段内反应物的浓度随时间的变化如图甲所示,正逆反应速率随时间的变化如图乙所示,下列说法中正确的是( )

A.30~40 min间该反应使用了催化剂
B.化学方程式中的x=1,正反应为吸热反应
C.30 min时降低温度,40 min时升高温度
D.8 min前A的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com