
【题目】已知草酸为二元弱酸:H2C2O4![]() HC2O4-+ H+ Ka1; HC2O4-
HC2O4-+ H+ Ka1; HC2O4-![]() C2O42-+ H + Ka2,常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是()
C2O42-+ H + Ka2,常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是()
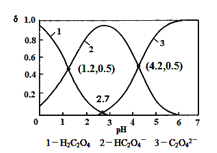
A.常温下,Ka1:Ka2=1000
B.将相同物质的量 KHC2O4和 K2C2O4固体完全溶于水可配得 pH 为 4.2 的混合液
C.pH=1.2溶液中:c(K +) + c(H +) = c(OH-) + c(H2C2O4)
D.向pH=1.2的溶液中加KOH 溶液将pH增大至4.2的过程中水的电离度一直增大
【答案】B
【解析】
A.电离平衡常数Ka1=[H+][HC2O4-]/[H2C2O4]=10-1.2,Ka2=[H+][C2O42-]/[HC2O4-]=10-4.2,Ka1:Ka2=1000,A项正确;
B.pH=4.2时,[HC2O4-]、[C2O42-]的浓度相等,而相同物质的量 KHC2O4和 K2C2O4固体完全溶于水得到的溶液, HC2O4-和C2O42-的水解程度不同,离子浓度不再相等,B项错误;
C.pH=1.2溶液中,存在电荷守恒c(K +) + c(H +) = c(OH-) + c(HC2O4-),c(HC2O4-)=c(H2C2O4),则c(K +) + c(H +) = c(OH-) + c(H2C2O4),C项正确;
D.随着KOH溶液的加入,HC2O4-的浓度逐渐减少,C2O42-的浓度增大,而HC2O4-的水解程度小于C2O42-的水解程度,盐的水解促进水的电离,所以向 pH=1.2的溶液中加 KOH 溶液将pH增大至4.2的过程中水的电离度一直增大,D项正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+ ![]() O2(g)=H2O(g);ΔH1= akJ·mol-1
O2(g)=H2O(g);ΔH1= akJ·mol-1
②2H2(g)+O2(g) = 2H2O(g);ΔH2= b kJ·mol-1 ③ H2(g)+ ![]() O2(g)=H2O(l);ΔH3= c kJ·mol-1
O2(g)=H2O(l);ΔH3= c kJ·mol-1
④2H2(g)+O2(g) = 2H2O(l);ΔH4= d kJ·mol-1,下列关系式中正确的是( )
A.2a=b<0B.b>d>0C.a<c<0D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2S溶液存在水解平衡:S2+H2O![]() HS+OH。下列说法正确的是( )
HS+OH。下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大
B. 升高温度,c(HS)/c(S2)增大
C. 加入NaOH固体,溶液pH减小
D. 通入CuSO4固体,HS浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示![]() 某些条件和部分产物已略去
某些条件和部分产物已略去![]() 下列说法错误的是
下列说法错误的是![]()
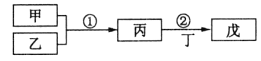
A.若戊为一种强碱且焰色反应为黄色,则反应![]() 可能都属于氧化还原反应
可能都属于氧化还原反应
B.常温下,若丙为无色气体,戊为红棕色气体,则甲、乙是铜和稀硝酸
C.若甲为硫磺燃烧产物,丁为水,则戊可用于干燥甲
D.若甲为浓盐酸,乙为![]() ,则戊可能使品红褪色
,则戊可能使品红褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。
(1)CO可用于合成甲醇。在体积可变的密闭容器中充入4molCO和8molH2,在催化剂作用下合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:
CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:

①该反应的逆反应属于________反应;(填“吸热”或“放热”)。
②在0.1Mpa 、100℃的条件下,该反应达到平衡时容器体积为开始容器体积的_________倍。(结果保留两位小数点)
③在温度和容积不变的情况下,再向平衡体系中充入4molCO,达到平衡时CO转化率________(填“增大”,“不变”或“减小”),平衡常数K________(填“增大”,“不变”或“减小”)。
(2)在反应(Ⅰ)中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
①CH4(g)+ H2O(g)= CO(g)+3H2(g) △H=+206.2 kJ·mol-1
②CH4(g)+ CO2(g)= 2CO(g)+2H2(g) △H=+247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为: 。
(3)在反应(Ⅰ)中制得的CH3OH 即可以做燃料,还可以与氧气组成碱性燃料电池,电解质溶液是20%~30%的KOH溶液。则该燃料电池放电时:负极的电极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物6.4 g在氧气中完全燃烧,只生成8.8 g CO2和7.2 g H2O。下列说法中正确的是( )
①该化合物仅含碳、氢两种元素 ②该化合物中碳、氢原子个数比为1∶4
③无法确定该化合物是否含有氧元素 ④该化合物中一定含有氧元素
A. ①②B. ②④C. ③④D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列设计的实验方案能达到实验目的是

A. 制备Fe(OH)2:用图1所示装置,向试管中加入NaOH溶液,振荡
B. 测定H2的生成速率:用图2所示装置,制取一定体积的H2,记录时间
C. 除去苯中少量苯酚:向苯和苯酚的混合液中加入浓溴水,过滤
D. 检验淀粉是否水解:取0.5 g淀粉于洁净的试管中,先加入5 mL稀硫酸,水浴加热,一段时间后再加入少量新制氢氧化铜悬浊液,水浴加热,观察实验现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A.工业上N2与H2合成NH3,往往需要使用催化剂
B.向1.50mol/L的硝酸铵溶液中加入少量氨水至中性,水的电离程度减小
C.密闭容器中2molCO与1molH2O(g)充分反应达平衡后,增大压强CO的反应速率加快
D.SO2与O2催化氧化成SO3是一个放热过程,450℃左右的温度比室温更有利于SO3生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com