
【题目】已知:①H2(g)+ ![]() O2(g)=H2O(g);ΔH1= akJ·mol-1
O2(g)=H2O(g);ΔH1= akJ·mol-1
②2H2(g)+O2(g) = 2H2O(g);ΔH2= b kJ·mol-1 ③ H2(g)+ ![]() O2(g)=H2O(l);ΔH3= c kJ·mol-1
O2(g)=H2O(l);ΔH3= c kJ·mol-1
④2H2(g)+O2(g) = 2H2O(l);ΔH4= d kJ·mol-1,下列关系式中正确的是( )
A.2a=b<0B.b>d>0C.a<c<0D.2c=d>0
【答案】A
【解析】
四个反应均为放热反应,即a、b、c、d均小于0,根据物质的状态及计量数比较a、b、c、d之间的关系和大小。
A. 反应①和②所有物质聚集状态相同,且反应②的计量数是反应①的2倍,则2a=b,所有反应均为放热反应,即a、b、c、d均小于0,因此2a=b<0,A项正确;
B. 四个反应均为放热反应,即a、b、c、d均小于0,B项错误;
C. 反应①和③对比,H2O的状态不同,从气态变为液态要放出热量,因此反应③放出的热量更多,那么c < a <0,C项错误;
D. 反应③和④所有物质聚集状态相同,且反应④的计量数是反应③的2倍,则2c=d,所有反应均为放热反应,即a、b、c、d均小于0,因此2c=d <0,D项错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】甲醇既是基本有机化工原料,又可作为燃料用于替代矿物燃料。
(1)工业上合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
平衡常数K | 2.041 | 0.270 | 0.012 |
由表中数据判断该反应为 ________反应(填“吸热”或“放热”)。 某温度下,将2 molCO和6 molH2充入2 L的密闭容器中充分反应,达到平衡后,测得c(CO)=0.2 mol/L,则CO的转化率为______,此时的温度为______(从表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2kJ/mol
③H2O(g)=H2O(l) ΔH3kJ/mol
则反应CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH= _____________ kJ/mol(用ΔH1、ΔH2、ΔH3表示)。
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72)时,实验室利用如图装置模拟该法:

①N电极的电极反应式为 ___________________________________。
②请完成电解池中Cr2O72转化为Cr3+的离子反应方程式:
Cr2O72 + ______ Fe2+ + ______ = ______ Cr3+ + ______ Fe3+ + ______
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×105 mol/L时,Cr3+沉淀完全,此时溶液的pH=______。(已知:Ksp=6.4×1031,lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于
A.1.7B.2.0C.12.0D.12.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。回答下列问题:

(1)液滴边缘是_______(填“正”或“负”)极区,发生的电极反应为____________________________。
(2)液滴中的Cl-由_______区向_______区迁移(填“b”或“a”)。
(3)在b区出现铁锈环的原因是液滴下的Fe因发生氧化反应而被腐蚀,生成的Fe2+_____________________进一步氧化、脱水形成铁锈。
(4)若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性HSO3->I-,氧化性IO3-> I2 。
(1)在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应。配平反应方程式并标出电子转移的方向和数目_______。
囗NaIO3+囗NaHSO3→ 囗I2+囗Na2SO4+囗H2SO4+囗H2O
(2)在NaIO3溶液中滴加过量NaHSO3溶液,反应完全后,推测反应后溶液中的还原产物为_______(填化学式);
(3)在含5molNaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和析出I2单质的物质的量的关系曲线如图所示。写出反应过程中与AB段曲线对应的离子方程式_______;当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图所示装置检验草酸亚铁晶体(FeC2O4·2H2O,淡黄色)受热分解的部分产物。下列说法正确的是( )
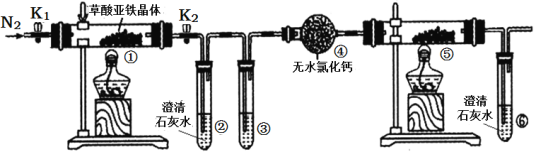
A. 通入N2的主要目的是防止空气中的水蒸气对产物检验产生影响
B. 若③和⑤中分别盛放足量NaOH溶液、CuO固体,可检验生成的CO
C. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
D. 若将④中的无水CaC12换成无水硫酸铜可检验分解生成的水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000 mol·L![]() NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L![]()
![]() 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是

A.点①所示溶液中:![]()
B.点②所示溶液中:![]()
C.点③所示溶液中:![]()
D.滴定过程中可能出现:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到实验目的是( )
序号 | 实验内容 | 实验目的 |
A | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
B | 向FeCl3+3KSCN | 说明增加生成物浓度,平衡逆向移动 |
C | 向盛有AgCl悬浊液的试管中滴加0.1mol·L-1NaI溶液,浊液变黄 | 证明相同温度下, KSP(AgCl)>KSP(AgI) |
D | 酸式滴定管中硫酸液面在20.00mL,将滴定管中液体全部放出 | 量取20.00mL硫酸溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸:H2C2O4![]() HC2O4-+ H+ Ka1; HC2O4-
HC2O4-+ H+ Ka1; HC2O4-![]() C2O42-+ H + Ka2,常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是()
C2O42-+ H + Ka2,常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是()
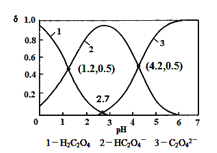
A.常温下,Ka1:Ka2=1000
B.将相同物质的量 KHC2O4和 K2C2O4固体完全溶于水可配得 pH 为 4.2 的混合液
C.pH=1.2溶液中:c(K +) + c(H +) = c(OH-) + c(H2C2O4)
D.向pH=1.2的溶液中加KOH 溶液将pH增大至4.2的过程中水的电离度一直增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com