
【题目】已知:还原性HSO3->I-,氧化性IO3-> I2 。
(1)在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应。配平反应方程式并标出电子转移的方向和数目_______。
囗NaIO3+囗NaHSO3→ 囗I2+囗Na2SO4+囗H2SO4+囗H2O
(2)在NaIO3溶液中滴加过量NaHSO3溶液,反应完全后,推测反应后溶液中的还原产物为_______(填化学式);
(3)在含5molNaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和析出I2单质的物质的量的关系曲线如图所示。写出反应过程中与AB段曲线对应的离子方程式_______;当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为_______mol。
【答案】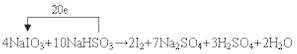 NaI IO3-+5I-+6H+=3I2+3H2O
NaI IO3-+5I-+6H+=3I2+3H2O ![]()
【解析】
(1)根据还原性HSO3->I-,氧化性IO3->I2来判断反应的产物,利用得失电子相等配平方程式;
(2)根据过量NaHSO3溶液的还原性和I2的氧化性能继续发生氧化还原反应来分析反应产物;
(3)根据图象及物质的量的关系来分析反应过程,结合电子守恒、电荷守恒写出离子方程式;根据反应2IO3-+6HSO3-═2I-+6SO42-+6H+,5molNaHSO3的溶液消耗NaIO3溶液的物质的量为![]() mol,生成碘离子的量为
mol,生成碘离子的量为![]() mol,设生成的碘单质的物质的量为xmol,则根据反应IO3-+6H++5I-═3H2O+3I2,消耗的NaIO3的物质的量为
mol,设生成的碘单质的物质的量为xmol,则根据反应IO3-+6H++5I-═3H2O+3I2,消耗的NaIO3的物质的量为![]() mol,剩余的碘离子的物质的量=(
mol,剩余的碘离子的物质的量=(![]() -
-![]() )mol,当溶液中n(I-):n(I2)=5:3时,即可求出x,最后根据原子守恒可以计算出加入碘酸钾的物质的量。
)mol,当溶液中n(I-):n(I2)=5:3时,即可求出x,最后根据原子守恒可以计算出加入碘酸钾的物质的量。
(1)NaIO3中I元素化合价由+5变为0,NaHSO3中S元素化合价由+4变为+6,根据得失电子守恒、质量守恒,配平反应方程式并标出电子转移的方向和数目为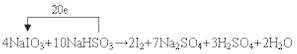 ;
;
(2)氧化剂化合价降低所得产物为还原产物,还原性HSO3->I-,氧化性IO3->I2;在NaIO3与足量NaHSO3溶液反应,NaIO3被还原为NaI,所以还原产物是NaI;
(3)在含5molNaHSO3的溶液中逐滴加入NaIO3溶液,OA段NaHSO3过量,NaIO3被还原为NaI;AB段NaI与NaIO3在酸性条件下发生反应生成碘单质,反应的离子方程式是IO3-+5I-+6H+=3I2+3H2O;根据反应2IO3-+6HSO3-═2I-+6SO42-+6H+,5molNaHSO3的溶液消耗NaIO3溶液的物质的量为![]() mol,生成碘离子的量为
mol,生成碘离子的量为![]() mol,设生成的碘单质的物质的量为xmol,则根据反应IO3-+6H++5I-═3H2O+3I2,消耗的NaIO3的物质的量为
mol,设生成的碘单质的物质的量为xmol,则根据反应IO3-+6H++5I-═3H2O+3I2,消耗的NaIO3的物质的量为![]() mol,剩余的碘离子的物质的量=(
mol,剩余的碘离子的物质的量=(![]() -
-![]() )mol,当溶液中n(I-):n(I2)=5:3时,即(
)mol,当溶液中n(I-):n(I2)=5:3时,即(![]() -
-![]() ):x=5:3,x=0.5mol,根据原子守恒加入碘酸钾的物质的量=
):x=5:3,x=0.5mol,根据原子守恒加入碘酸钾的物质的量=mol+0.5mol×
![]() mol=
mol=![]() mol。
mol。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为 ___________________。
②下列方法中,可以使醋酸稀溶液中 CH3COOH 电离程度增大的是 __________________(填字母序号)。
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
(2)用 0.1 mol·L-1NaOH 溶液分别滴定体积均为 20.00 mL、浓度均为 0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液 pH随加入 NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是_______________(填“I”或“II”)。
②室温时,若 0.1 mol·L-1的醋酸的电离度为 1%,计算这醋酸溶液的 pH 值________。
③滴定开始前,三种溶液中由水电离出的 c(H+)最大的是________________。
④上述用 0.1 mol·L-1的 NaOH 溶液滴定 0.1 mol·L-1的盐酸,下列操作不正确的是________________。
A.用标准 NaOH 溶液润洗碱式滴定管后,再装入标准碱溶液
B.用待测酸溶液润洗锥形瓶后,再装入待测酸溶液
C.滴定时两眼应注视滴定管中液面的变化,以免滴定过量
D.读数时,视线应与滴定管凹液面的最低点保持水平
⑤上述滴定用酚酞作指示剂,滴定终点的现象_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、M、N是短周期主族元素,且原子序数依次增大。已知X原子的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大。下列说法正确的是
A.Y2X和Y2X2中化学键类型相同,阴、阳离子的个数比相同
B.气态氢化物的热稳定性:M>N
C.M与X的化合物对应的水化物一定是强酸.
D.离子半径![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示。下列有关叙述中,正确的是
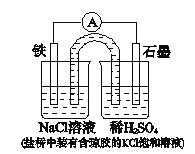
A.Fe作正极,发生氧化反应
B.负极反应: 2H+ + 2e-=H2↑
C.工作一段时间后,两烧杯中溶液pH均不变
D.工作一段时间后,NaCl溶液中c(Cl-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,a、b都是惰性电极,通电一段时间后,a极附近溶液呈红色.

(1)电源的负极是_____,B中的阳极是_____。
(2)电极质量增加的是_____,A溶液的pH_____(填“增大”“减小”或“不变”)。
(3)B装置用U形管的原因是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+ ![]() O2(g)=H2O(g);ΔH1= akJ·mol-1
O2(g)=H2O(g);ΔH1= akJ·mol-1
②2H2(g)+O2(g) = 2H2O(g);ΔH2= b kJ·mol-1 ③ H2(g)+ ![]() O2(g)=H2O(l);ΔH3= c kJ·mol-1
O2(g)=H2O(l);ΔH3= c kJ·mol-1
④2H2(g)+O2(g) = 2H2O(l);ΔH4= d kJ·mol-1,下列关系式中正确的是( )
A.2a=b<0B.b>d>0C.a<c<0D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用硫酸厂炉渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO47H2O),聚铁的化学式为[Fe2(OH)n(SO4)3﹣0.5n]m,制备过程如图所示:下列说法不正确的是
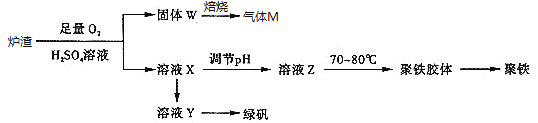
A. 炉渣中FeS与硫酸和氧气的反应的离子方程式为:4FeS+3O2+12H+=4Fe3++4S↓+6H2O
B. 气体M的成分是SO2,通入双氧水得到硫酸,可循环使用
C. 向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸发浓缩、冷却结晶、过滤等步骤得到绿矾
D. 溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度和压强不变的条件下,发生可逆反应:A(g)+3B(g) ![]() 4C(g),下列叙述能作为该反应达到平衡状态的标志的是( )
4C(g),下列叙述能作为该反应达到平衡状态的标志的是( )
A.混合气体的平均摩尔质量不再变化B.v(A)∶v(B)∶v(C)=1∶3∶4
C.混合气体的密度不再变化D.C的体积分数不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。
(1)CO可用于合成甲醇。在体积可变的密闭容器中充入4molCO和8molH2,在催化剂作用下合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:
CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:

①该反应的逆反应属于________反应;(填“吸热”或“放热”)。
②在0.1Mpa 、100℃的条件下,该反应达到平衡时容器体积为开始容器体积的_________倍。(结果保留两位小数点)
③在温度和容积不变的情况下,再向平衡体系中充入4molCO,达到平衡时CO转化率________(填“增大”,“不变”或“减小”),平衡常数K________(填“增大”,“不变”或“减小”)。
(2)在反应(Ⅰ)中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
①CH4(g)+ H2O(g)= CO(g)+3H2(g) △H=+206.2 kJ·mol-1
②CH4(g)+ CO2(g)= 2CO(g)+2H2(g) △H=+247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为: 。
(3)在反应(Ⅰ)中制得的CH3OH 即可以做燃料,还可以与氧气组成碱性燃料电池,电解质溶液是20%~30%的KOH溶液。则该燃料电池放电时:负极的电极反应式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com