
【题目】X、Y、M、N是短周期主族元素,且原子序数依次增大。已知X原子的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大。下列说法正确的是
A.Y2X和Y2X2中化学键类型相同,阴、阳离子的个数比相同
B.气态氢化物的热稳定性:M>N
C.M与X的化合物对应的水化物一定是强酸.
D.离子半径![]()
【答案】D
【解析】
根据题意知X、Y、M、N是短周期主族元素,且原子序数依次增大。X原子的最外层电子数是电子层数的3倍,则X为氧元素;X、M同主族,则M为硫元素,N为氯元素;Y原子在短周期主族元素中原子半径最大,则Y为钠元素。
A.Na2O中的化学键为离子键,Na2O2中的化学键为离子键和共价键,化学键类型不同,错误;
B.同周期由左向右元素的非金属性逐渐增强,气态氢化物的稳定性逐渐增强,则气态氢化物的热稳定性:S<Cl,即M<N,错误;
C.S与O的化合物SO2对应的水化物亚硫酸为弱酸,错误;
D.O2-和Na+电子层结构相同,核电荷数越大,半径越小,故离子半径r:r(X2-)>r(Y+),正确。
故选D。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】汉黄苓素是传统中草药黄答的有效成分之一,其结构如图所示,其对杀伤肿瘤细胞有独特作用。 下列有关汉黄素的叙述正确的是

A. 该物质分子中所有原子有可能在同一平面内
B. 汉黄荃素的分子式为C16H1305
C. 1mol该物质最多可与2 mol Br2发生加成反应
D. 与足量H发生加成反应后,该分子中官能团的种类减少2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制纯碱的化学史上,侯德榜使用而索尔维法没有使用的反应原理的化学方程式是( )
A.CO2+NaCl+NH3+H2O→NaHCO3↓+NH4Cl
B.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.CaO+2NH4Cl→CaCl2+2NH3↑+H2O
D.NaHCO3+NH3+NaCl→Na2CO3+NH4Cl↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂以食盐等为原料,生产烧碱、盐酸等化工产品。工艺流程可简单表示如图:
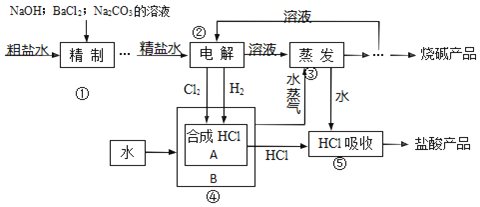
完成下列填空:
(1)粗盐水中含有 MgCl2、CaCl2、Na2SO4 等可溶性杂质,①步骤必须先后加入稍过量的 NaOH、BaCl2、Na2CO3溶液后过滤除杂。试写出加入 Na2CO3溶液时发生反应的离子方程式:______。写出②步骤发生反应的化学方程式:______。
(2)③步骤之后获得干燥的烧碱产品的有关操作有______。进行④步骤的生产设备 A、B之间传递的是(选填编号)______。
A.只有物料
B.既有物料又有能量
C.只有能量
D.既无物料也无能量
(3)如果用下列装置在实验室进行⑤步骤的实验,正确的是(选填编号)______。

若检验烧碱产品中是否含有少量 NaCl 杂质的实验方案是______。
(4)为测定烧碱产品的纯度,准确称取 5.000g 样品(杂质不含碱性物质)置于烧杯中,加水搅拌,冷却至室温后,将溶液全部转移入 1000mL 的容量瓶之后的一步操作是______。从所配得的溶液中每次都取出 20.00mL,用 0.12mol/L的盐酸滴定(选用常用指示剂),两次分别用去盐酸溶液19.81mL 和 19.79mL.判断滴定终点的依据是______,根据实验数据计算此烧碱产品的纯度为(保留两位小数)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于
A.1.7B.2.0C.12.0D.12.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物G的合成路线如下:

已知:C为烃
(1)A中含氧官能团名称为:____________。
(2)E的化学名称为:__________________。
(3)F→G的反应类型___________________。
(4)F的结构简式_____________________________。
(5)写反应①的化学方程式________________________________。
(6)写出D生成E的化学方程式________________________________。
(7)满足下列条件B的同分异构体有________种,其中核磁共振氢谱图中峰的面积之比为1∶2∶2∶3的结构为__________________(任意写一种)。①含苯环结构;②只有一种官能团。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性HSO3->I-,氧化性IO3-> I2 。
(1)在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应。配平反应方程式并标出电子转移的方向和数目_______。
囗NaIO3+囗NaHSO3→ 囗I2+囗Na2SO4+囗H2SO4+囗H2O
(2)在NaIO3溶液中滴加过量NaHSO3溶液,反应完全后,推测反应后溶液中的还原产物为_______(填化学式);
(3)在含5molNaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和析出I2单质的物质的量的关系曲线如图所示。写出反应过程中与AB段曲线对应的离子方程式_______;当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)氯化铝水溶液呈________(填“酸”、“中”或“碱”)性,原因是(用离子方程式表示)________________________________________;
(2)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的__________(填化学式)。
(3)已知纯水在T℃时,pH=6,该温度下某NaOH溶液的浓度为1 mol·L-1,则该溶液由水电离出的c(OH-)=________mol·L-1。
(4)常温下,浓度均为0.1 mol/L的五种溶液的pH如下表所示。
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
根据表中数据,回答问题:
①常温下,等浓度的下列四种酸溶液,pH最小的是______;
A.HCN B.HClO C.H2CO3 D.CH3COOH
②等体积等浓度的NaCN、NaClO两溶液中所含阴、阳离子总数的大小关系为__。
A.前者大 B.相等 C.后者大 D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com