
【题目】请回答下列问题:
(1)氯化铝水溶液呈________(填“酸”、“中”或“碱”)性,原因是(用离子方程式表示)________________________________________;
(2)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的__________(填化学式)。
(3)已知纯水在T℃时,pH=6,该温度下某NaOH溶液的浓度为1 mol·L-1,则该溶液由水电离出的c(OH-)=________mol·L-1。
(4)常温下,浓度均为0.1 mol/L的五种溶液的pH如下表所示。
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
根据表中数据,回答问题:
①常温下,等浓度的下列四种酸溶液,pH最小的是______;
A.HCN B.HClO C.H2CO3 D.CH3COOH
②等体积等浓度的NaCN、NaClO两溶液中所含阴、阳离子总数的大小关系为__。
A.前者大 B.相等 C.后者大 D.无法确定
【答案】酸 Al3++3H2O ![]() Al(OH)3+3H+ NaOH 10-12 D C
Al(OH)3+3H+ NaOH 10-12 D C
【解析】
(1)在氯化铝水溶液中,Al3+发生水解,生成H+,由此可推出溶液的性质,原因是铝离子发生水解反应;
(2)硫化钠在溶液中发生水解,生成NaHS和NaOH,为了防止发生水解,可以加入少量的碱。
(3)已知纯水在T℃时,pH=6,该温度下KW=10-6×10-6=10-12。某NaOH溶液的浓度为1 mol·L-1,则该溶液由水电离出的c(OH-)=![]() mol·L-1。
mol·L-1。
(4) pH越小,溶液的碱性越弱,对应酸的酸性越强。
①常温下, pH最小,酸性相对最强,等浓度的四种酸溶液,CH3COOH的 pH最小;
②等体积等浓度的NaCN、NaClO两溶液中,发生如下水解:CN-+H2O![]() HCN+OH-,ClO-+H2O
HCN+OH-,ClO-+H2O![]() HClO+OH-,NaCN溶液中c(Na+)+c(CN-)+c(OH-)(水解生成)与NaClO溶液中c(Na+)+c(ClO-)+c(OH-)(水解生成)相等,NaCN的pH大,则表明水解生成的c(OH-)大,水电离产生的c(H+)小,所含阴、阳离子总数小。
HClO+OH-,NaCN溶液中c(Na+)+c(CN-)+c(OH-)(水解生成)与NaClO溶液中c(Na+)+c(ClO-)+c(OH-)(水解生成)相等,NaCN的pH大,则表明水解生成的c(OH-)大,水电离产生的c(H+)小,所含阴、阳离子总数小。
(1)在氯化铝水溶液中,Al3+发生水解,生成H+,由此可推出溶液显酸性,原因是Al3++3H2O ![]() Al(OH)3+3H+;答案为:酸;Al3++3H2O
Al(OH)3+3H+;答案为:酸;Al3++3H2O ![]() Al(OH)3+3H+;
Al(OH)3+3H+;
(2)硫化钠在溶液中发生水解,生成NaHS和NaOH,为了防止发生水解,可以加入少量的NaOH。答案为:NaOH;
(3)已知纯水在T℃时,pH=6,该温度下KW=10-6×10-6=10-12。某NaOH溶液的浓度为1 mol·L-1,则该溶液由水电离出的c(OH-)=![]() =10-12mol·L-1。答案为:10-12;
=10-12mol·L-1。答案为:10-12;
(4)pH越小,溶液的碱性越弱,对应酸的酸性越强。
①常温下, pH最小,酸性相对最强,等浓度的四种酸溶液,CH3COOH 的pH最小;答案为:D;
②等体积等浓度的NaCN、NaClO两溶液中,发生如下水解:CN-+H2O![]() HCN+OH-,ClO-+H2O
HCN+OH-,ClO-+H2O![]() HClO+OH-,NaCN溶液中c(Na+)+c(CN-)+c(OH-)(水解生成)与NaClO溶液中c(Na+)+c(ClO-)+c(OH-)(水解生成)相等,NaCN的pH大,则表明水解生成的c(OH-)大,水电离产生的c(H+)小,所含阴、阳离子总数小。答案为:C。
HClO+OH-,NaCN溶液中c(Na+)+c(CN-)+c(OH-)(水解生成)与NaClO溶液中c(Na+)+c(ClO-)+c(OH-)(水解生成)相等,NaCN的pH大,则表明水解生成的c(OH-)大,水电离产生的c(H+)小,所含阴、阳离子总数小。答案为:C。


科目:高中化学 来源: 题型:
【题目】X、Y、M、N是短周期主族元素,且原子序数依次增大。已知X原子的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大。下列说法正确的是
A.Y2X和Y2X2中化学键类型相同,阴、阳离子的个数比相同
B.气态氢化物的热稳定性:M>N
C.M与X的化合物对应的水化物一定是强酸.
D.离子半径![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用硫酸厂炉渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO47H2O),聚铁的化学式为[Fe2(OH)n(SO4)3﹣0.5n]m,制备过程如图所示:下列说法不正确的是
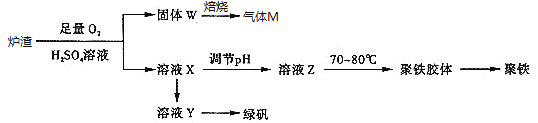
A. 炉渣中FeS与硫酸和氧气的反应的离子方程式为:4FeS+3O2+12H+=4Fe3++4S↓+6H2O
B. 气体M的成分是SO2,通入双氧水得到硫酸,可循环使用
C. 向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸发浓缩、冷却结晶、过滤等步骤得到绿矾
D. 溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度和压强不变的条件下,发生可逆反应:A(g)+3B(g) ![]() 4C(g),下列叙述能作为该反应达到平衡状态的标志的是( )
4C(g),下列叙述能作为该反应达到平衡状态的标志的是( )
A.混合气体的平均摩尔质量不再变化B.v(A)∶v(B)∶v(C)=1∶3∶4
C.混合气体的密度不再变化D.C的体积分数不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时,将n mol·L-1氨水滴入10 mL 1.0 mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是
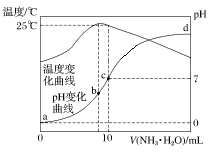
A.a点Kw=1.0×10-14
B.25 ℃时NH4Cl水解常数为(n-1)×10-7 mol·L-1
C.b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.水的电离程度:b>c>a>d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2S溶液存在水解平衡:S2+H2O![]() HS+OH。下列说法正确的是( )
HS+OH。下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大
B. 升高温度,c(HS)/c(S2)增大
C. 加入NaOH固体,溶液pH减小
D. 通入CuSO4固体,HS浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:
i.CO(g)+2H2(g)![]() CH3OH(g) H1=90.1kJ·mol1
CH3OH(g) H1=90.1kJ·mol1
ii.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) H2=24.5kJ·mol1
CH3OCH3(g)+H2O(g) H2=24.5kJ·mol1
当其他条件相同时,由H2和CO直接制备二甲醚的反应中,CO平衡转化率随条件X 的变化曲线如右图所示。下列说法正确的是
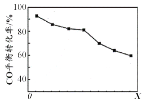
A . 由H2和CO直接制备二甲醚的反应为放热反应
B. 条件X为压强
C. X增大,二甲醚的产率一定增大
D. X增大,该反应的平衡常数一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。
(1)CO可用于合成甲醇。在体积可变的密闭容器中充入4molCO和8molH2,在催化剂作用下合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:
CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:

①该反应的逆反应属于________反应;(填“吸热”或“放热”)。
②在0.1Mpa 、100℃的条件下,该反应达到平衡时容器体积为开始容器体积的_________倍。(结果保留两位小数点)
③在温度和容积不变的情况下,再向平衡体系中充入4molCO,达到平衡时CO转化率________(填“增大”,“不变”或“减小”),平衡常数K________(填“增大”,“不变”或“减小”)。
(2)在反应(Ⅰ)中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
①CH4(g)+ H2O(g)= CO(g)+3H2(g) △H=+206.2 kJ·mol-1
②CH4(g)+ CO2(g)= 2CO(g)+2H2(g) △H=+247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为: 。
(3)在反应(Ⅰ)中制得的CH3OH 即可以做燃料,还可以与氧气组成碱性燃料电池,电解质溶液是20%~30%的KOH溶液。则该燃料电池放电时:负极的电极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中所含杂质(括号中的物质)所选用的试剂和装置均正确的是( )
Ⅰ.试剂:①KMnO4酸性溶液 ②NaOH溶液 ③饱和Na2CO3溶液 ④H2O ⑤Na ⑥溴水 ⑦Br2的CCl4溶液
Ⅱ.装置:

选项 | 物质 | 试剂 | 装置 |
A | C2H6(C2H4) | ⑥ | ① |
B | 苯(苯酚) | ① | ③ |
C | CH3COOC2H5(CH3COOH) | ③ | ② |
D | 甲苯(二甲苯) | ⑦ | ④ |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com