
【题目】工业制纯碱的化学史上,侯德榜使用而索尔维法没有使用的反应原理的化学方程式是( )
A.CO2+NaCl+NH3+H2O→NaHCO3↓+NH4Cl
B.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.CaO+2NH4Cl→CaCl2+2NH3↑+H2O
D.NaHCO3+NH3+NaCl→Na2CO3+NH4Cl↓
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
2R—C≡C—H![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)B的结构简式为______,D 的化学名称为______。
(2)①和③的反应类型分别为______、______。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气_______mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式_______________________________。
(6)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为 ___________________。
②下列方法中,可以使醋酸稀溶液中 CH3COOH 电离程度增大的是 __________________(填字母序号)。
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
(2)用 0.1 mol·L-1NaOH 溶液分别滴定体积均为 20.00 mL、浓度均为 0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液 pH随加入 NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是_______________(填“I”或“II”)。
②室温时,若 0.1 mol·L-1的醋酸的电离度为 1%,计算这醋酸溶液的 pH 值________。
③滴定开始前,三种溶液中由水电离出的 c(H+)最大的是________________。
④上述用 0.1 mol·L-1的 NaOH 溶液滴定 0.1 mol·L-1的盐酸,下列操作不正确的是________________。
A.用标准 NaOH 溶液润洗碱式滴定管后,再装入标准碱溶液
B.用待测酸溶液润洗锥形瓶后,再装入待测酸溶液
C.滴定时两眼应注视滴定管中液面的变化,以免滴定过量
D.读数时,视线应与滴定管凹液面的最低点保持水平
⑤上述滴定用酚酞作指示剂,滴定终点的现象_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向盐酸中加入氨水至中性,溶液中 >1
>1
B.醋酸溶液和氢氧化钠溶液恰好反应,溶液中![]() >1
>1![]()
C.向0.1molL-1CH3COOH溶液中加入少量水,溶液中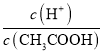 减小
减小
D.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某华人科学家和他的团队研发出“纸电池” (如图)。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为: Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是

A.该电池的正极材料为锌
B.该电池反应中二氧化锰发生了氧化反应
C.电池的正极反应式为2MnO2 +2H2O+2e-= 2MnO(OH)+2OH-
D.当有0.1mol锌溶解时,流经电解液的电子数为1.204×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂生产新型清洁燃料甲醚(CH3-O-CH3)的流水线反应原理为:在 10L 的反应容器内进行的反应①的化学平衡常数表达式为K=[CO][H2]/[H2O]。反应②的热化学方程式为:3H2(g)+3CO(g)CH3OCH3(g)+CO2(g)+Q。反应③为:CO2+NH3+H2O→NH4HCO3,完成下列填空:
(1)反应①的方程式为______。经3min反应容器内的水蒸气从20.0mol变为 2.0mol,则此 3min 内 CO 的平均反应速率V(CO)=______。
(2)能判断反应①已达化学平衡状态的是(选填编号)______。
A.在消耗 n 摩尔氢气的同时产生 n 摩尔的水
B.容器内气体的平均相对分子质量保持不变
C.容器内所有的物质的总物质的量保持不变
D.化学反应速率:V(逆)(H2O)=V(正)(CO)
(3)已知升高温度,反应②的化学平衡常数会减小,则反应②的热化学方程式中的Q(选填“>”或“<”)______0。该反应的逆反应速率V(逆)随时间 t 变化的关系如图一所示,则在 t2时改变的反应条件是______。
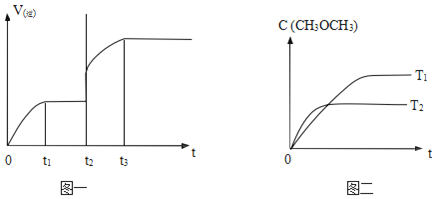
(4)在不同温度下,反应容器内甲醚(CH3OCH3)的浓度c(CH3OCH3)随时间t 变化的状况如图二所示。则反应温度 T1(选填“>”、“=”或“<”)______T2。
(5)若反应③得到的是一种纯净常见化肥的溶液。经测定溶液中也存在 NH3H2O 分子和CO32-离子,试用化学用语表示产生这两种微粒的原因:______,______。相同温度下,都为 0.1mol/L的 NaHCO3溶液甲和 NH4HCO3溶液乙相比较,溶液中c(CO32-)甲(选填“>”、“=”或“<”)甲______乙。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、M、N是短周期主族元素,且原子序数依次增大。已知X原子的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大。下列说法正确的是
A.Y2X和Y2X2中化学键类型相同,阴、阳离子的个数比相同
B.气态氢化物的热稳定性:M>N
C.M与X的化合物对应的水化物一定是强酸.
D.离子半径![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示。下列有关叙述中,正确的是
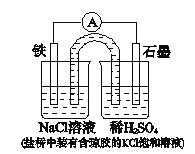
A.Fe作正极,发生氧化反应
B.负极反应: 2H+ + 2e-=H2↑
C.工作一段时间后,两烧杯中溶液pH均不变
D.工作一段时间后,NaCl溶液中c(Cl-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度和压强不变的条件下,发生可逆反应:A(g)+3B(g) ![]() 4C(g),下列叙述能作为该反应达到平衡状态的标志的是( )
4C(g),下列叙述能作为该反应达到平衡状态的标志的是( )
A.混合气体的平均摩尔质量不再变化B.v(A)∶v(B)∶v(C)=1∶3∶4
C.混合气体的密度不再变化D.C的体积分数不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com