
科目: 来源: 题型:
【题目】电化学原理在化学工业中有广泛的应用。请根据如图回答问题:
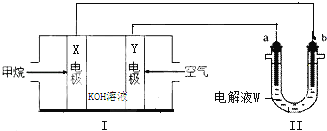
(1)装置Ⅰ中的X电极的名称是____________,Y电极的电极反应式为________,工作一段时间后,电解液的pH将________(填“增大”、“减小”、“不变”)。
(2)若装置Ⅱ中a、b均为Pt电极,W为饱和食盐水(滴有几滴酚酞),实验开始后,观察到b电极周围溶液变红色,其原因是(用电极反应式表示)___________,a电极上有气泡产生,该气体的电子式为____。
(3)若利用装置Ⅱ进行铜的精炼,则a电极的材料为_______________,工作一段时间后装置Ⅱ电解液中c(Cu2+)将_______________(填“增大”、“减小”、“不变”)。
(4)若装置Ⅱ中a为Ag棒,b为铜棒,W为AgNO3溶液,工作一段时间后发现铜棒增重2.1.6g,则流经电路的电子的物质的量为___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图装置闭合电键时,电流表A的指针将发生偏转。试回答下列问题。
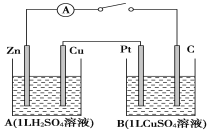
(1)A池是________,Zn的电极名称是________;B池是________,Pt的电极名称是________。
(2)写出下列有关反应:
Zn极上电极反应:___________________________________________;
Pt极上电极反应:___________________________________________。
(3)B池中的总反应的化学方程式为_________________________________。
(4)如果要用B池给铁片上镀上一层Cu,则B池应作何改进___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现用Pt电极电解1 L浓度均为0.1 mol·L-1的HCl、CuSO4的混合溶液,装置如图,下列说法正确的是( )

A.电解开始时阴极有H2放出
B.电解开始时阳极上发生:Cu2++2e-Cu
C.整个电解过程中,SO42-不参与电极反应
D.当电路中通过电子的量超过0.1 mol时,此时阴极放电的离子发生了变化
查看答案和解析>>
科目: 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右图所示,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是

A. 铜电极发生还原反应 B. 石墨电极上产生氢气
C. 铜电极接直流电源的负极 D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目: 来源: 题型:
【题目】铜锌原电池(如图)工作时,下列叙述错误的是( )
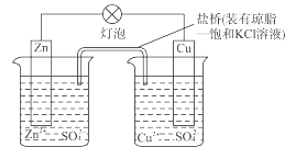
A. 正极反应为:Cu2++2e–= Cu
B. 电池反应为:Zn+Cu2+=Zn2+ +Cu
C. 在外电路中,电子从负极流向正极
D. 盐桥中的K+移向ZnSO4溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同
B.配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度
C.用加热的方法可以除去KCl溶液中的Fe3+
D.为抑制Fe3+的水解,较好地保存FeCl3溶液,应加少量盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物HIn在水溶液中因存在以下电离平衡HIn(aq,红色) ![]() H+(aq)+ In-(aq,黄色)故可作酸碱指示剂。浓度为0.02mol/L的下列溶液:① 盐酸 ② 石灰水 ③ NaCl溶液 ④ NaHSO4溶液 ⑤ NaHCO3溶液 ⑥ 氨水,其中能使指示剂显红色的是
H+(aq)+ In-(aq,黄色)故可作酸碱指示剂。浓度为0.02mol/L的下列溶液:① 盐酸 ② 石灰水 ③ NaCl溶液 ④ NaHSO4溶液 ⑤ NaHCO3溶液 ⑥ 氨水,其中能使指示剂显红色的是
A. ④⑤B. ③⑤C. ①④D. ②⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa。常温下,某浓度H2A溶液在不同pH值下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示。下列说法正确的是
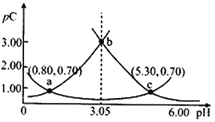
A. pH=3.50时,c(H2A)>c(HA-)>c(A2-)
B. 常温下,pKa1(H2A)=5.30,pKa2(H2A)=0.80
C. b点时,![]() =104.50
=104.50
D. pH=3.00~5.30时,c(H2A)+c(HA-)+c(A2-)先增大后减小
查看答案和解析>>
科目: 来源: 题型:
【题目】某![]() 的溶液X,其中可能含有
的溶液X,其中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的一种或几种,取200 mL该溶液进行实验,其现象及转化如图.
中的一种或几种,取200 mL该溶液进行实验,其现象及转化如图.
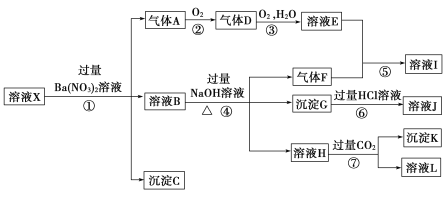
已知:反应过程中有一种气体是红棕色.
请回答下列问题:
(1)仅由强酸性条件便可判断溶液X中一定不存在的离子有________.
(2)溶液X中,关于![]() 的判断一定正确的是________(填字母).
的判断一定正确的是________(填字母).
a.一定有 b.一定没有 c.可能有
(3)①中产生气体A的离子方程式为_____________________________________________________.
(4)⑦中生成沉淀K的离子方程式为_____________________________________________________.
(5)溶液X中不能确定的离子是_____________________用实验证明该离子一定不存在的化学方法为______________________________________________________________________________________.
(6)若实验测定A.F.K均为![]() l,试确定沉淀C及其物质的量范围:_________.
l,试确定沉淀C及其物质的量范围:_________.
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需配制0.2000molL﹣1Na2S2O3标准溶液450mL,并利用该溶液对某浓度的NaClO溶液进行标定.
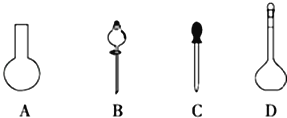
(1)若用Na2S2O3固体来配制标准溶液,在如图所示的仪器中,不必要用到的仪器是_________(填字母),还缺少的玻璃仪器是_________(填仪器名称)。
(2)根据计算需用天平称取Na2S2O3固体的质量是_________g。在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度_________(填“>”“<”或“=”,下同)0.2000molL﹣1.若还未等溶液冷却就定容了,则所得溶液浓度_________0.2000molL﹣1。
(3)用滴定法标定的具体方法:量取20.00mL NaClO溶液于锥形瓶中,加入适量稀盐酸和足量KI固体,用0.2000molL﹣1Na2S2O3标准溶液滴定至终点(淀粉溶液作指示剂),四次平行实验测定的V(Na2S2O3)数据如下:
(已知:I2+2Na2S2O3═2NaI+Na2S4O6)
测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
V(Na2S2O3)/mL | 21.90 | 18.80 | 22.10 | 22.00 |
①NaClO溶液中加入适量稀盐酸和足量KI固体时发生反应的离子方程式为_________。
②NaClO溶液的物质的量浓度是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com