
科目: 来源: 题型:
【题目】下列反应不属于水解反应或水解方程式不正确的是 ( )
①HCl+H2O![]() H3O++Cl-
H3O++Cl-
②AlCl3+3H2O=Al(OH)3+3HCl
③Na2CO3+2H2O![]() H2CO3+2NaOH
H2CO3+2NaOH
④碳酸氢钠溶液:HCO3—+H2O=CO32—+H3O+
⑤NH4Cl溶于D2O中:NH4++D2O![]() NH3·D2O+H+
NH3·D2O+H+
A.①②③④B.①②③C.②③⑤D.全部
查看答案和解析>>
科目: 来源: 题型:
【题目】处理烟气中的SO2可以采用碱吸——电解法,其流程如左图;模拟过程Ⅱ如右图,下列推断正确的是


A. 膜1为阴离子交换膜,膜2为阳离子交换膜
B. 若用锌锰碱性电池为电源,a极与锌极相连
C. a极的电极反应式为2H2O一4e一=4H++O2↑
D. 若收集22.4L的P(标准状况下),则转移4mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】已知化合物X由4种元素组成,某学习小组进行了如下实验:
![]()
已知:步骤②中消耗KI0.15mol
请回答:
(1)X的化学式是___,黄色溶液乙与SO2反应的离子方程式是___。
(2)X中一种元素对应的单质,与足量的K2CO3溶液反应得到的产物中含溶液甲中溶质,写出该反应的化学方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )

A. 三种酸的电离常数关系:KHA>KHB>KHD
B. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】烃A中碳、氢两种元素的质量比是24:5,G具有浓郁的香味。它们之间的转化关系如下(含有相同官能团的有机物通常具有相似的化学性质):
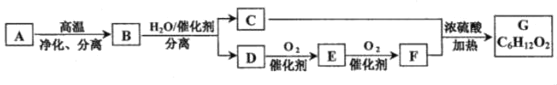
请回答:
(1)化合物B所含的官能团的名称是___。
(2)D的结构简式是___。
(3)C+F→G的化学方程式是___。
(4)下列说法正确的是___。
A.在工业上,A→B的过程可以获得汽油等轻质油
B.有机物C与D都能与金属钠反应,C经氧化也可得到F
C.可以用碳酸钠溶液鉴别E、F、G
D.等质量的E、G混合物,无论以何比例混合,完全燃烧耗氧量相同
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙组同学分别做了以下探究实验。
(1)甲组探究![]() 与
与![]() 溶液反应,实验装置如下:
溶液反应,实验装置如下:
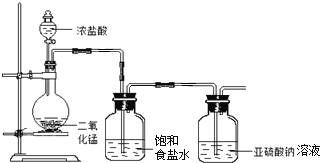
①请指出该装置的不足之处 ______ 、 ______ 。
②![]() 与
与![]() 溶液反应的离子方程式为 ______ 。
溶液反应的离子方程式为 ______ 。
③设计实验,简述实验步骤,证明洗气瓶中的![]() 已被氧化 ______ 。
已被氧化 ______ 。
(2)乙组探究乙酸乙酯![]() 沸点
沸点![]() 在不同温度、不同浓度NaOH溶液中的水解速率。取四支大小相同的试管,在试管外壁贴上体积刻度纸,按下表进行对照实验。在两种不同温度的水浴中加热相同时间后,记录酯层的体积来确定水解反应的速率
在不同温度、不同浓度NaOH溶液中的水解速率。取四支大小相同的试管,在试管外壁贴上体积刻度纸,按下表进行对照实验。在两种不同温度的水浴中加热相同时间后,记录酯层的体积来确定水解反应的速率
试管Ⅰ | 试管Ⅱ | 试管Ⅲ | 试管Ⅳ | |
乙酸乙酯 | 1 | V1 | V2 | V3 |
| V4 | 3 | 0 | V5 |
蒸馏水 | 0 | V6 | 5 | 2 |
④请完成上表,其中![]() ______ ,
______ ,![]() ______ ,
______ ,![]() ______ 。
______ 。
⑤实验中,可用饱和食盐水替代蒸馏水,其优点是 ______ ;但不能用饱和![]() 溶液替代蒸馏水,其原因是 ______ 。
溶液替代蒸馏水,其原因是 ______ 。
⑥实验中,试管Ⅳ比试管Ⅱ中的酯层减少更快,其原因有:温度高速率快,还可能有 ______。
查看答案和解析>>
科目: 来源: 题型:
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)工业上可用煤制天然气,生产过程中有多种途径生成![]()
①写出![]() 与
与![]() 反应生成
反应生成![]() 和
和![]() 的热化学方程式 ______。
的热化学方程式 ______。
已知:![]() ,
,
![]() ,
,
![]()
②科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以![]() 和
和![]() 合成
合成![]()
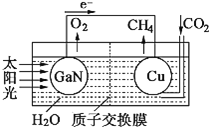
写出铜电极表面的电极反应式 ______ 。为提高该人工光合系统的工作效率,可向装置中加入少量 ______ ![]() 选填“盐酸”或“硫酸”
选填“盐酸”或“硫酸”![]() 。
。
③另一生成![]() 的途径是
的途径是![]() ,某温度下,将
,某温度下,将![]() 和
和![]() 充入10L的密闭容器内发生反应
充入10L的密闭容器内发生反应![]() ,平衡时
,平衡时![]() 的转化率为
的转化率为![]() ,求此温度下该反应的平衡常数
,求此温度下该反应的平衡常数![]() ______
______ ![]() 计算结果保留两位有效数字
计算结果保留两位有效数字![]() 。
。
(2)天然气中的![]() 杂质常用氨水吸收,产物为
杂质常用氨水吸收,产物为![]() ,一定条件下向
,一定条件下向![]() 溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 ______。
溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 ______。
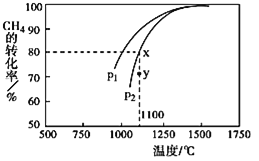
(3)天然气的一个重要用途是制取![]() ,其原理为:
,其原理为:![]() 。在密闭容器中通入物质的量浓度均为
。在密闭容器中通入物质的量浓度均为![]() 的
的![]() 与
与![]() ,在一定条件下发生反应,测得
,在一定条件下发生反应,测得![]() 的平衡转化率与温度及压强的关系如图所示,则压强
的平衡转化率与温度及压强的关系如图所示,则压强![]() ______
______ ![]() (填“大于”或“小于”
(填“大于”或“小于”![]() ;压强为
;压强为![]() 时,在y点:v(正) ______ v(逆)(填“大于”、“小于”或“等于”)。
时,在y点:v(正) ______ v(逆)(填“大于”、“小于”或“等于”)。
(4)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃![]() 由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图,则X的结构简式为 ______。
由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图,则X的结构简式为 ______。
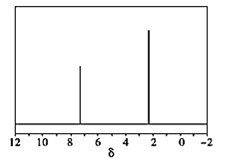
查看答案和解析>>
科目: 来源: 题型:
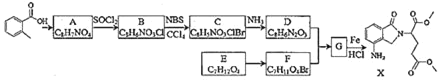
【题目】某研究小组拟合成医药中间体X和Y。
已知:① ;②
;②![]() ;③
;③
请回答:
(1)下列说法正确的是___。
A.化合物A不能使酸性KMnO4溶液褪色
B.化合物C能发生加成、取代、消去反应
C.化合物D能与稀盐酸发生反应
D.X的分子式是C15H18N2O5
(2)化合物B的结构简式是___。
(3)写出D+F→G的化学方程式___。
(4)写出化合物A(C8H7NO4)同时符合下列条件的同分异构体的结构简式___。
①分子是苯的二取代物,1H﹣NHR谱表明分子中有4种化学环境不同的氢原子
②分子中存在硝基和![]() 结构
结构
(5)设计E→Y(![]() )的合成路线(用流程图表示,无机试剂任选)___。
)的合成路线(用流程图表示,无机试剂任选)___。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知烃B分子内C、H原子个数比为1︰2,相对分子质量为28,核磁共振氢谱显示分子中只有一种化学环境的氢原子,且有如下的转化关系:
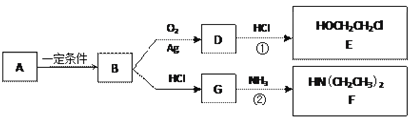
(1)B的结构简式是_________________
(2)A可能属于下列哪类物质___________
a.醇 b.卤代烃 c.酚 d.羧酸
(3)反应①是D与HCl按物质的量之比1︰1的加成反应,则D的分子式是___________。
反应②可表示为:G + NH3→ F + HCl (未配平),该反应配平后的化学方程式是(有机化合物均用结构简式表示): ____________________________________
化合物E(HOCH2CH2Cl)和 F [ HN(CH2CH3)2 ]是药品普鲁卡因合成的重要中间体,普鲁卡因的合成路线如下:(已知:![]() )
)
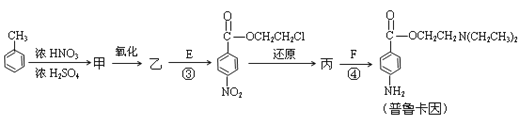
(4)甲的结构简式是 _________________。
由甲苯生成甲的反应类型是_________________。
(5)乙中有两种含氧官能团,反应③的化学方程式是___________________________________
(6)丙中官能团的名称是_______________________________________。
(7)普鲁卡因有两种水解产物丁和戊。
① 戊与甲互为同分异构体,戊的结构简式是_____________________。
② 戊经聚合反应制成的高分子纤维广泛用于通讯、宇航等领域。该聚合反应的化学方程式是__________________________________________。
③ D的红外光谱表明分子内除C—H键、C—C键外还含有两个C—O单键。则D与F在一定条件下反应生成丁的化学方程式是________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物在工农业生产和生命活动中起着重要作用。
(1)氨气是一种重要的化工原料,氨态氮肥是常用的肥料。
哈伯法合成氨技术的相关反应为:N2(g)+3H2(g)![]() 2NH3(g) △H=-93kJ/mol,实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
2NH3(g) △H=-93kJ/mol,实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
①合成氨技术是氮的固定的一种,属于______(选填“大气固氮”、“生物固氮”“人工固氮”)。
②合成氨反应常用铁触媒催化剂,下列关于催化剂的说法不正确的是_________。
A.可以加快反应速率 B.可以改变反应热
C.可以减少反应中的能耗 D.可以增加活化分子的数目
③关于合成氨工艺的下列理解,正确的是_________。
A.原料气中N2过量,是因N2相对易得,适度过量有利于提高H2的转化率
B.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
(2)肼(N2H4)是氮的氢化物之一,其制备方法可用次氯酸钠氧化过量的氨气。
①次氯酸钠溶液显碱性,表示原理的离子方程式是_________________________。
②常温下,该水解反应的平衡常数为K=1.0×10-6mol/L,则1.0mol/LNaClO溶液的pH=____。
③肼与N2O4氧化反应生成N2和水蒸气。
已知:N2(g)+2O2(g)=N2O4(l) △H=-19.5kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-534.2kJ/mol
请写出肼和N2O4反应的热化学反应方程式_________________________________。
(3)在NH4HCO3溶液中,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7)。
NH3·H2O+H2CO3的平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com