
ΓΨΧβΡΩΓΩΡ≥―–ΨΩ–ΓΉιΡβΚœ≥…“Ϋ“©÷–ΦδΧεXΚΆYΓΘ
“―÷ΣΘΚΔΌ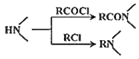 ΘΜΔΎ
ΘΜΔΎ![]() ΘΜΔέ
ΘΜΔέ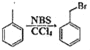
«κΜΊ¥πΘΚ
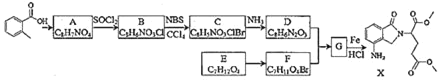
Θ®1Θ©œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «___ΓΘ
AΘ°Μ·ΚœΈοA≤ΜΡή ΙΥα–‘KMnO4»ή“ΚΆ …Ϊ
BΘ°Μ·ΚœΈοCΡήΖΔ…ζΦ”≥…ΓΔ»Γ¥ζΓΔœϊ»ΞΖ¥”Π
CΘ°Μ·ΚœΈοDΡή”κœΓ―ΈΥαΖΔ…ζΖ¥”Π
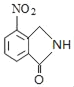
DΘ°XΒΡΖ÷Ή” Ϋ «C15H18N2O5
Θ®2Θ©Μ·ΚœΈοBΒΡΫαΙΙΦρ Ϋ «___ΓΘ
Θ®3Θ©–¥≥ωD+FΓζGΒΡΜ·―ßΖΫ≥Χ Ϋ___ΓΘ
Θ®4Θ©–¥≥ωΜ·ΚœΈοAΘ®C8H7NO4Θ©Ά§ ±ΖϊΚœœ¬Ν–ΧθΦΰΒΡΆ§Ζ÷“λΙΙΧεΒΡΫαΙΙΦρ Ϋ___ΓΘ
ΔΌΖ÷Ή” «±ΫΒΡΕΰ»Γ¥ζΈοΘ§1H©¹NHRΤΉ±μΟςΖ÷Ή”÷–”–4÷÷Μ·―ßΜΖΨ≥≤ΜΆ§ΒΡ«β‘≠Ή”
ΔΎΖ÷Ή”÷–¥φ‘ΎœθΜυΚΆ![]() ΫαΙΙ
ΫαΙΙ
Θ®5Θ©…ηΦΤEΓζYΘ®![]() Θ©ΒΡΚœ≥…¬ΖœΏΘ®”ΟΝς≥ΧΆΦ±μ ΨΘ§ΈόΜζ ‘ΦΝ»Έ―ΓΘ©___ΓΘ
Θ©ΒΡΚœ≥…¬ΖœΏΘ®”ΟΝς≥ΧΆΦ±μ ΨΘ§ΈόΜζ ‘ΦΝ»Έ―ΓΘ©___ΓΘ
ΓΨ¥πΑΗΓΩCD 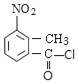
 +CH3OOCCHBrCH2CH2COOCH3Γζ
+CH3OOCCHBrCH2CH2COOCH3Γζ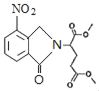 +HBr
+HBr ![]() ΓΔ
ΓΔ![]() ΓΔ
ΓΔ![]() ΓΔ
ΓΔ![]() CH3OOCCH2CH2CH2COOCH3
CH3OOCCH2CH2CH2COOCH3![]() HOOCCH2CH2CH2COOH
HOOCCH2CH2CH2COOH![]() ClOCCH2CH2CH2COCl
ClOCCH2CH2CH2COCl![]()
![]()
ΓΨΫβΈωΓΩ
”…![]() ΓΔAΒΡΖ÷Ή” ΫΘ§ΉίΙέ’ϊΗωΙΐ≥ΧΘ§ΫαΚœXΒΡΫαΙΙΘ§Ω…÷Σ
ΓΔAΒΡΖ÷Ή” ΫΘ§ΉίΙέ’ϊΗωΙΐ≥ΧΘ§ΫαΚœXΒΡΫαΙΙΘ§Ω…÷Σ![]() ΖΔ…ζΦΉΜυΝΎΈΜœθΜ·Ζ¥”Π…ζ≥…AΈΣ
ΖΔ…ζΦΉΜυΝΎΈΜœθΜ·Ζ¥”Π…ζ≥…AΈΣ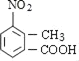 Θ§Ε‘±»ΗςΈο÷ ΒΡΖ÷Ή”Θ§ΫαΚœΖ¥”ΠΧθΦΰ”κΗχ”ηΒΡΖ¥”Π–≈œΔΘ§Ω…÷ΣA÷–τ»Μυ…œτ«Μυ±Μ¬»‘≠Ή”»Γ¥ζ…ζ≥…BΘ§B÷–ΦΉΜυ…œH‘≠Ή”±Μδε‘≠Ή”»Γ¥ζ…ζ≥…CΘ§C÷–¬»‘≠Ή”ΓΔδε‘≠Ή”±Μ©¹NH©¹»Γ¥ζ…ζ≥…DΘ§Ι BΈΣ
Θ§Ε‘±»ΗςΈο÷ ΒΡΖ÷Ή”Θ§ΫαΚœΖ¥”ΠΧθΦΰ”κΗχ”ηΒΡΖ¥”Π–≈œΔΘ§Ω…÷ΣA÷–τ»Μυ…œτ«Μυ±Μ¬»‘≠Ή”»Γ¥ζ…ζ≥…BΘ§B÷–ΦΉΜυ…œH‘≠Ή”±Μδε‘≠Ή”»Γ¥ζ…ζ≥…CΘ§C÷–¬»‘≠Ή”ΓΔδε‘≠Ή”±Μ©¹NH©¹»Γ¥ζ…ζ≥…DΘ§Ι BΈΣ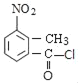 ΓΔCΈΣ
ΓΔCΈΣ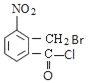 ΓΔDΈΣ
ΓΔDΈΣ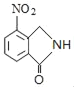 ΘΜ”…XΒΡΫαΙΙΘ§ΡφΆΤΩ…÷ΣGΈΣ
ΘΜ”…XΒΡΫαΙΙΘ§ΡφΆΤΩ…÷ΣGΈΣ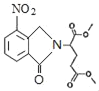 Θ§ΫαΚœFΓΔEΒΡΖ÷Ή” ΫΘ§Ω…ΆΤ÷ΣFΈΣCH3OOCCHBrCH2CH2COOCH3ΓΔEΈΣCH3OOCCH2CH2CH2COOCH3Θ§Ψί¥ΥΖ÷ΈωΫβ¥πΓΘ
Θ§ΫαΚœFΓΔEΒΡΖ÷Ή” ΫΘ§Ω…ΆΤ÷ΣFΈΣCH3OOCCHBrCH2CH2COOCH3ΓΔEΈΣCH3OOCCH2CH2CH2COOCH3Θ§Ψί¥ΥΖ÷ΈωΫβ¥πΓΘ
Θ®1Θ©A.Μ·ΚœΈοAΈΣ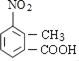 Θ§±ΫΜΖΝ§Ϋ”ΦΉΜυΘ§Ρή ΙΥα–‘KMnO4»ή“ΚΆ …ΪΘ§Ι A’ΐ»ΖΘΜ
Θ§±ΫΜΖΝ§Ϋ”ΦΉΜυΘ§Ρή ΙΥα–‘KMnO4»ή“ΚΆ …ΪΘ§Ι A’ΐ»ΖΘΜ
B.Μ·ΚœΈοCΈΣ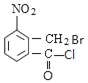 Θ§±ΫΜΖΡή”κ«βΤχΖΔ…ζΦ”≥…Ζ¥”ΠΘ§¬±ΥΊ‘≠Ή”ΡήΖΔ…ζ»Γ¥ζΖ¥”ΠΘ§≤ΜΡήΖΔ…ζœϊ»ΞΖ¥”ΠΘ§Ι B¥μΈσΘΜ
Θ§±ΫΜΖΡή”κ«βΤχΖΔ…ζΦ”≥…Ζ¥”ΠΘ§¬±ΥΊ‘≠Ή”ΡήΖΔ…ζ»Γ¥ζΖ¥”ΠΘ§≤ΜΡήΖΔ…ζœϊ»ΞΖ¥”ΠΘ§Ι B¥μΈσΘΜ
C.Μ·ΚœΈοD Θ§Κ§”–θΘΑΖΦϋΘ§Ρή”κœΓ―ΈΥαΖΔ…ζΖ¥”ΠΘ§Ι C’ΐ»ΖΘΜ
Θ§Κ§”–θΘΑΖΦϋΘ§Ρή”κœΓ―ΈΥαΖΔ…ζΖ¥”ΠΘ§Ι C’ΐ»ΖΘΜ
D.”…ΫαΙΙΩ…÷ΣΘ§XΒΡΖ÷Ή” Ϋ «C15H18N2O5Θ§Ι D’ΐ»ΖΘ§Ι ¥πΑΗΈΣΘΚCDΘΜ
Θ®2Θ©”…Ζ÷ΈωΩ…÷ΣΘ§Μ·ΚœΈοBΒΡΫαΙΙΦρ Ϋ «ΘΚ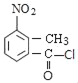 Θ§Ι ¥πΑΗΈΣΘΚ
Θ§Ι ¥πΑΗΈΣΘΚ ΘΜ
ΘΜ
Θ®3Θ©D+FΓζGΒΡΜ·―ßΖΫ≥Χ ΫΘΚ +CH3OOCCHBrCH2CH2COOCH3Γζ
+CH3OOCCHBrCH2CH2COOCH3Γζ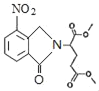 +HBrΘ§Ι ¥πΑΗΈΣΘΚ
+HBrΘ§Ι ¥πΑΗΈΣΘΚ +CH3OOCCHBrCH2CH2COOCH3Γζ
+CH3OOCCHBrCH2CH2COOCH3Γζ +HBrΘΜ
+HBrΘΜ
Θ®4Θ©Μ·ΚœΈοAΘ®C8H7NO4Θ©ΒΡΆ§Ζ÷“λΙΙΧεΆ§ ±ΖϊΚœœ¬Ν–ΧθΦΰΘΚΔΌΖ÷Ή” «±ΫΒΡΕΰ»Γ¥ζΈοΘ§1H©¹NHRΤΉ±μΟςΖ÷Ή”÷–”–4÷÷Μ·―ßΜΖΨ≥≤ΜΆ§ΒΡ«β‘≠Ή”Θ§¥φ‘ΎΕ‘≥ΤΫαΙΙΘΜΔΎΖ÷Ή”÷–¥φ‘ΎœθΜυΚΆ![]() ΫαΙΙΘ§2Ηω»Γ¥ζΜυΩ…ΡήΫαΙΙΈΣΘΚ©¹NO2”κ©¹CH2OOCHΓΔ©¹NO2”κ©¹CH2COOHΓΔ©¹COOH”κ©¹CH2NO2ΓΔ©¹OOCH”κ©¹CH2NO2Θ§Ά§Ζ÷“λΙΙΧεΩ…ΡήΫαΙΙΦρ ΫΈΣΘΚ
ΫαΙΙΘ§2Ηω»Γ¥ζΜυΩ…ΡήΫαΙΙΈΣΘΚ©¹NO2”κ©¹CH2OOCHΓΔ©¹NO2”κ©¹CH2COOHΓΔ©¹COOH”κ©¹CH2NO2ΓΔ©¹OOCH”κ©¹CH2NO2Θ§Ά§Ζ÷“λΙΙΧεΩ…ΡήΫαΙΙΦρ ΫΈΣΘΚ![]() ΓΔ
ΓΔ![]() ΓΔ
ΓΔ![]() ΓΔ
ΓΔ![]() Θ§Ι ¥πΑΗΈΣΘΚ
Θ§Ι ¥πΑΗΈΣΘΚ![]() ΓΔ
ΓΔ![]() ΓΔ
ΓΔ![]() ΓΔ
ΓΔ![]() ΘΜ
ΘΜ
Θ®5Θ©”…–≈œΔΔΌΩ…÷ΣΘ§”…ClOCCH2CH2CH2COCl”κΑ±ΤχΖ¥”Π…ζ≥…![]() Θ§”…AΓζBΒΡΉΣΜ·Θ§”…HOOCCH2CH2CH2COOH”κSOCl2 Ζ¥”ΠΒΟΒΫClOCCH2CH2CH2COClΘ§CH3OOCCH2CH2CH2COOCH3Φν–‘ΧθΦΰœ¬Υ°ΫβΓΔΥαΜ·ΒΟΒΫHOOCCH2CH2CH2COOHΘ§Κœ≥…¬ΖœΏΝς≥ΧΆΦΈΣΘΚCH3OOCCH2CH2CH2COOCH3
Θ§”…AΓζBΒΡΉΣΜ·Θ§”…HOOCCH2CH2CH2COOH”κSOCl2 Ζ¥”ΠΒΟΒΫClOCCH2CH2CH2COClΘ§CH3OOCCH2CH2CH2COOCH3Φν–‘ΧθΦΰœ¬Υ°ΫβΓΔΥαΜ·ΒΟΒΫHOOCCH2CH2CH2COOHΘ§Κœ≥…¬ΖœΏΝς≥ΧΆΦΈΣΘΚCH3OOCCH2CH2CH2COOCH3![]() HOOCCH2CH2CH2COOH
HOOCCH2CH2CH2COOH![]() ClOCCH2CH2CH2COCl
ClOCCH2CH2CH2COCl![]()
![]() Θ§Ι ¥πΑΗΈΣΘΚCH3OOCCH2CH2CH2COOCH3
Θ§Ι ¥πΑΗΈΣΘΚCH3OOCCH2CH2CH2COOCH3![]() HOOCCH2CH2CH2COOH
HOOCCH2CH2CH2COOH![]() ClOCCH2CH2CH2COCl
ClOCCH2CH2CH2COCl![]()
![]() ΓΘ
ΓΘ


 ΧλΧλœρ…œ“Μ±ΨΚΟΨμœΒΝ–¥πΑΗ
ΧλΧλœρ…œ“Μ±ΨΚΟΨμœΒΝ–¥πΑΗ –Γ―ß…ζ10Ζ÷÷””Π”ΟΧβœΒΝ–¥πΑΗ
–Γ―ß…ζ10Ζ÷÷””Π”ΟΧβœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩXΓΔYΓΔZΓΔWΈΣ‘≠Ή”–ρ ΐ“ά¥Έ‘ω¥σΒΡΥΡ÷÷ΕΧ÷ήΤΎ‘ΣΥΊ,Τδ÷–ZΈΣΫπ τ‘ΣΥΊ,XΓΔWΈΣΆ§“Μ÷ςΉε‘ΣΥΊΓΘXΓΔZΓΔW–Έ≥…ΒΡΉνΗΏΦέ―θΜ·ΈοΖ÷±πΈΣΦΉΓΔ““ΓΔ±ϊΓΘxΓΔy2ΓΔzΓΔwΖ÷±πΈΣXΓΔYΓΔZΓΔWΒΡΒΞ÷ Θ§ΕΓ «Μ·ΚœΈοΓΘΤδΉΣΜ·ΙΊœΒ»γΆΦΥυ ΨΘ§œ¬Ν–≈–Εœ¥μΈσΒΡ «Θ® Θ©

A. Ζ¥”ΠΔΌΓΔΔΎΓΔΔέΕΦ τ”Ύ―θΜ·ΜΙ‘≠Ζ¥”Π B. XΓΔYΓΔZΓΔWΥΡ÷÷‘ΣΥΊ÷–Θ§YΒΡ‘≠Ή”ΑκΨΕΉν–Γ
C. NaΉ≈Μπ ±Θ§Ω…”ΟΦΉΤΥΟπ D. “ΜΕ®ΧθΦΰœ¬Θ§x”κΦΉΖ¥”Π…ζ≥…ΕΓ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷ΣΘΚΔΌAΒΡ≤ζΝΩΆ®≥Θ”Οά¥ΚβΝΩ“ΜΗωΙζΦ“ΒΡ ·”ΆΜ·ΙΛΥ°ΤΫΘΜΔΎ2CH3CHOΘΪO2![]() 2CH3COOHΓΘœ÷“‘AΈΣ÷ς“Σ‘≠ΝœΚœ≥…Μ·ΚœΈοEΘ§ΤδΚœ≥…¬ΖœΏ»γΆΦ1Υυ ΨΓΘΜΊ¥πœ¬Ν–Έ ΧβΘΚ
2CH3COOHΓΘœ÷“‘AΈΣ÷ς“Σ‘≠ΝœΚœ≥…Μ·ΚœΈοEΘ§ΤδΚœ≥…¬ΖœΏ»γΆΦ1Υυ ΨΓΘΜΊ¥πœ¬Ν–Έ ΧβΘΚ

Θ®1Θ©–¥≥ωœ¬Ν–Έο÷ ΒΡΙΌΡήΆ≈Οϊ≥ΤΘΚBΘΚ____________________ΘΜDΘΚ____________________ΓΘ
Θ®2Θ©Ζ¥”ΠΔήΒΡΜ·―ßΖΫ≥Χ ΫΈΣ________________________________________________Θ§Ζ¥”Πάύ–ΆΘΚ________ΓΘ
Θ®3Θ©Ρ≥―ßœΑ–ΓΉι…ηΦΤΈο÷ B¥ΏΜ·―θΜ·ΒΡ Β―ιΉΑ÷Ο»γœ¬Θ§ΗυΨίΆΦ2ΉΑ÷ΟΜΊ¥πΈ ΧβΓΘ

ΔΌΉΑ÷ΟΦΉΉΕ–ΈΤΩ÷– ΔΖ≈ΒΡΙΧΧε“©ΤΖΩ…ΡήΈΣ________(ΧνΉ÷ΡΗ)ΓΘ
AΘ°Na2O2 BΘ°KClCΘ°Na2CO3 DΘ°MnO2
ΔΎ Β―ιΙΐ≥Χ÷–Θ§±ϊΉΑ÷Ο”≤÷ ≤ΘΝßΙή÷–ΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ_______________________________ΓΘ
ΔέΈο÷ BΒΡ¥ΏΜ·―θΜ·≤ζΈο”κΤœΧ―Χ«ΨΏ”–œύΆ§ΒΡΧΊ’ςΖ¥”ΠΘ§ΫΪΥυΒΟΒΡ―θΜ·≤ζΈοΒΈΦ”ΒΫ–¬÷Τ«β―θΜ·Ά≠–ϋΉ«“Κ÷–Φ”»»Θ§œ÷œσΈΣ______________________________________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν––π ω÷–¥μΈσΒΡ «
A.‘Ύ¥ΩΥ°÷–Φ”»κ…ΌΝΩΝρΥαοßΘ§Ω…“÷÷ΤΥ°ΒΡΒγάκΘ°
B.…ΐΗΏΈ¬Ε»Θ§ΜνΜ·Ζ÷Ή”ΑΌΖ÷ ΐ“ΜΕ®‘ω¥σ,Μ·―ßΖ¥”ΠΥΌ¬ “ΜΕ®‘ω¥σ
C.‘Ύ¥ΉΥαΡΤ»ή“Κ÷–Φ”»κ…ΌΝΩ«β―θΜ·ΡΤΘ§»ή“Κ÷–c(OHΘ≠)‘ω¥σ
D.Υδ»ΜΙΧΧ嬻̷ΡΤ≤ΜΡήΒΦΒγΘ§ΒΪ¬»Μ·ΡΤ «ΒγΫβ÷
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΫΪ2molAΤχΧεΚΆ![]() ΤχΧε‘ΎΙΧΕ®ΧεΜΐΒΡΟή±’»ίΤς÷–ΜλΚœ≤Δ‘Ύ“ΜΕ®ΧθΦΰœ¬ΖΔ…ζ»γœ¬Ζ¥”Π≤Δ¥οΒΫΤΫΚβΉ¥Χ§ΘΚ
ΤχΧε‘ΎΙΧΕ®ΧεΜΐΒΡΟή±’»ίΤς÷–ΜλΚœ≤Δ‘Ύ“ΜΕ®ΧθΦΰœ¬ΖΔ…ζ»γœ¬Ζ¥”Π≤Δ¥οΒΫΤΫΚβΉ¥Χ§ΘΚ![]()
![]() Θ§¥ΥΖ¥”ΠΈΣΖ≈»»Ζ¥”ΠΓΘœ¬Ν–Ρή‘ω¥σ’ΐΓΔΡφΖ¥”ΠΥΌ¬ ΒΡΖΫΖ® «ΘΚΔΌ‘Ό≥δ»κ1molAΤχΧεΘΜΔΎ≥δ»κ2molΒΡΕη–‘ΤχΧεΘΜΔέΦ”»κ’ΐ¥ΏΜ·ΦΝΘΜΔή…ΐΗΏΈ¬Ε»ΘΜΔί“ΤΉΏ≤ΩΖ÷CΤχΧεΓΘΤδ÷–’ΐ»ΖΒΡ «
Θ§¥ΥΖ¥”ΠΈΣΖ≈»»Ζ¥”ΠΓΘœ¬Ν–Ρή‘ω¥σ’ΐΓΔΡφΖ¥”ΠΥΌ¬ ΒΡΖΫΖ® «ΘΚΔΌ‘Ό≥δ»κ1molAΤχΧεΘΜΔΎ≥δ»κ2molΒΡΕη–‘ΤχΧεΘΜΔέΦ”»κ’ΐ¥ΏΜ·ΦΝΘΜΔή…ΐΗΏΈ¬Ε»ΘΜΔί“ΤΉΏ≤ΩΖ÷CΤχΧεΓΘΤδ÷–’ΐ»ΖΒΡ «
A.ΔΌΔέΔίB.ΔΌΔέΔήC.ΔΌΔΎΔήΔίD.ΔΌΔΎΔέΔήΔί
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷ΣΜ·ΚœΈοX”…4÷÷‘ΣΥΊΉι≥…Θ§Ρ≥―ßœΑ–ΓΉιΫχ––ΝΥ»γœ¬ Β―ιΘΚ
![]()
“―÷ΣΘΚ≤Ϋ÷ηΔΎ÷–œϊΚΡKI0.15mol
«κΜΊ¥πΘΚ
Θ®1Θ©XΒΡΜ·―ß Ϋ «___Θ§ΜΤ…Ϊ»ή“Κ““”κSO2Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ «___ΓΘ
Θ®2Θ©X÷–“Μ÷÷‘ΣΥΊΕ‘”ΠΒΡΒΞ÷ Θ§”κΉψΝΩΒΡK2CO3»ή“ΚΖ¥”ΠΒΟΒΫΒΡ≤ζΈο÷–Κ§»ή“ΚΦΉ÷–»ή÷ Θ§–¥≥ωΗΟΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΘΚ___ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬ΆΦΈΣΡ≥Εΰ¥ΈΒγ≥Ί≥δΒγ ±ΒΡΙΛΉς‘≠άμ Ψ“βΆΦΘ§ΗΟΙΐ≥ΧΩ… Βœ÷―Έ»ή“ΚΒΡΒ≠Μ·ΓΘœ¬Ν–ΥΒΖ®¥μΈσΒΡ «

A. ≥δΒγ ±Θ§aΈΣΒγ‘¥’ΐΦΪ
B. ≥δΒγ ±Θ§Cl-œρBiΒγΦΪ“ΤΕ·Θ§Na+œρNaTi2(PO4)2ΒγΦΪ“ΤΕ·
C. ≥δΒγ ±Θ§–¬‘ω»κΒγΦΪ÷–ΒΡΈο÷ ΘΚn(Na+)ΘΚn(Cl-)=1:3
D. Ζ≈Βγ ±Θ§’ΐΦΪΒΡΒγΦΪΖ¥”ΠΈΣBiOCl+2H++3e-=Bi+Cl-+H2O
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΙΛ“Β…œ≥Θ”ΟΜΙ‘≠≥ΝΒμΖ®¥ΠάμΚ§ΗθΖœΥ°Θ®Cr2O72ΓΣΚΆCrO42ΓΣΘ©Θ§ΤδΝς≥ΧΈΣΘΚ
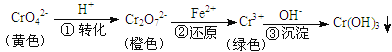
“―÷ΣΘΚ≤Ϋ÷ηΔέ…ζ≥…ΒΡCr(OH)3‘Ύ»ή“Κ÷–¥φ‘Ύ“‘œ¬≥ΝΒμ»ήΫβΤΫΚβΘΚ
Cr(OH)3(s)![]() Cr3+(aq)+3OHΓΣ(aq) Ksp=c(Cr3+)ΓΛc3(OHΓΣ)=10-32
Cr3+(aq)+3OHΓΣ(aq) Ksp=c(Cr3+)ΓΛc3(OHΓΣ)=10-32
œ¬Ν–”–ΙΊΥΒΖ®≤Μ’ΐ»ΖΒΡ «
A.≤Ϋ÷ηΔΌ÷–Β±v’ΐ(CrO42ΓΣ)=2vΡφ(Cr2O72ΓΣ) ±Θ§ΥΒΟςΖ¥”ΠΘΚ2CrO42ΓΣ+2H+![]() Cr2O72ΓΣ+H2O¥οΒΫΤΫΚβΉ¥Χ§
Cr2O72ΓΣ+H2O¥οΒΫΤΫΚβΉ¥Χ§
B.»τœρK2Cr2O7»ή“Κ÷–Φ”NaOH≈®»ή“ΚΘ§»ή“ΚΩ…”…≥»…Ϊ±δΜΤ…Ϊ
C.≤Ϋ÷ηΔΎ÷–Θ§»τ“ΣΜΙ‘≠1 mol Cr2O72ΓΣάκΉ”Θ§–η“Σ12 mol (NH4)2Fe(SO4)2
D.≤Ϋ÷ηΔέ÷–Θ§Β±ΫΪ»ή“ΚΒΡpHΒςΫΎ÷Ν5 ±Θ§Ω…»œΈΣΖœΥ°÷–ΒΡΗθ‘ΣΥΊ“―Μυ±Ψ≥ΐΨΓΘ®Β±»ή“Κ÷–c(Cr3+)Γή10-5mol/L ±Θ§Ω… ”ΉςΗΟάκΉ”≥ΝΒμΆξ»ΪΘ©
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ―θΜ·ΟΨ‘Ύ“Ϋ“©ΓΔΫ®÷ΰΒ»––“Β”Π”ΟΙψΖΚΓΘΝρΥαΟΨΜΙ‘≠»»Ϋβ÷Τ±ΗΗΏ¥Ω―θΜ·ΟΨ «“Μ÷÷–¬ΒΡΧΫΥςΓΘ“‘ΝβΟΨΩσ(÷ς“Σ≥…Ζ÷ΈΣMgCO3Θ§Κ§…ΌΝΩFeCO3)ΈΣ‘≠Νœ÷Τ±ΗΗΏ¥Ω―θΜ·ΟΨΒΡ Β―ιΝς≥Χ»γœ¬ΘΚ
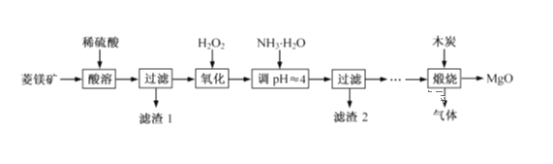
(1)MgCO3”κœΓΝρΥαΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ__________________________ΓΘ
(2)Φ”»κH2O2―θΜ· ±,ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ__________________________ΓΘ
(3)¬Υ‘ϋ2 ΒΡ≥…Ζ÷ «____________(ΧνΜ·―ß Ϋ),Ιΐ¬ΥΖ÷άκ–η“ΣΒΡ≤ΘΝß“«Τς”– __________________ΓΘ
(4)λ―…’Ιΐ≥Χ¥φ‘Ύ“‘œ¬Ζ¥”ΠΘΚ
2MgSO4+CΘΫ2MgO+2SO2Γϋ+CO2Γϋ
MgSO4+CΘΫMgO+SO2Γϋ+COΓϋ
MgSO4+3CΘΫMgO+SΓϋ+3COΓϋ
άϊ”ΟΆΦΉΑ÷ΟΕ‘λ―…’≤ζ…ζΒΡΤχΧεΫχ––Ζ÷≤ΫΈϋ ’Μρ ’Φ·ΓΘ
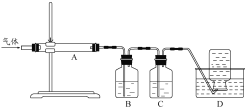
D÷–Ά®Ιΐ≈≈Υ°Ζ® ’Φ·ΒΡΤχΧεΩ…“‘ «___________(ΧνΜ·―ß Ϋ)ΓΘC÷–»ή“Κ”Ο”ΎΈϋ ’CO2Θ§B÷– ΔΖ≈ΒΡ»ή“ΚΩ…“‘ «___________(ΧνΉ÷ΡΗ)ΓΘ
aΘ°NaOH »ή“Κ bΘ°Na2CO3 »ή“Κ cΘ°œΓœθΥα dΘ°KMnO4»ή“Κ
(5)A÷–ΒΟΒΫΒΡΒ≠ΜΤ…ΪΙΧΧε”κ»»ΒΡNaOH»ή“ΚΖ¥”ΠΘ§≤ζΈο÷–‘ΣΥΊΉνΗΏΦέΧ§ΈΣ+4Θ§–¥≥ωΗΟΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΘΚ______________________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com