
【题目】工业上常用还原沉淀法处理含铬废水(Cr2O72—和CrO42—),其流程为:
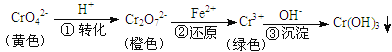
已知:步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)![]() Cr3+(aq)+3OH—(aq) Ksp=c(Cr3+)·c3(OH—)=10-32
Cr3+(aq)+3OH—(aq) Ksp=c(Cr3+)·c3(OH—)=10-32
下列有关说法不正确的是
A.步骤①中当v正(CrO42—)=2v逆(Cr2O72—)时,说明反应:2CrO42—+2H+![]() Cr2O72—+H2O达到平衡状态
Cr2O72—+H2O达到平衡状态
B.若向K2Cr2O7溶液中加NaOH浓溶液,溶液可由橙色变黄色
C.步骤②中,若要还原1 mol Cr2O72—离子,需要12 mol (NH4)2Fe(SO4)2
D.步骤③中,当将溶液的pH调节至5时,可认为废水中的铬元素已基本除尽(当溶液中c(Cr3+)≤10-5mol/L时,可视作该离子沉淀完全)
【答案】C
【解析】
A、步骤①中当v正(CrO42—)=2v逆(Cr2O72—)时,符合该反应2CrO42—+2H+![]() Cr2O72—+H2O的正逆反应速率相等,为平衡状态,A正确;
Cr2O72—+H2O的正逆反应速率相等,为平衡状态,A正确;
B、若向K2Cr2O7溶液中加NaOH浓溶液,则氢氧根离子与氢离子反应生成水,所以氢离子浓度减小,2CrO42—+2H+![]() Cr2O72—+H2O平衡逆向移动,CrO42—的浓度增大,溶液由橙色变为黄色,B正确;
Cr2O72—+H2O平衡逆向移动,CrO42—的浓度增大,溶液由橙色变为黄色,B正确;
C、步骤②中,若要还原1 mol Cr2O72—离子,则生成2molCr3+,Cr元素的化合价从+6价降低到+3价,得到6mol电子,而Fe2+被氧化为Fe3+,失去1个电子,根据得失电子守恒,需要6molFe2+,所以需要6mol (NH4)2Fe(SO4)2,C错误;
D、步骤③中,当将溶液的pH调节至5时,氢氧根离子浓度为10-9mol/L,根据Ksp=c(Cr3+)·c3(OH—)=10-32,此时c(Cr3+)=10-5mol/L,所以可认为废水中的铬元素已基本除尽,D正确;
答案选C。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

(1)毒重石用盐酸浸取前需充分研磨,目的是________。实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的________。
a.烧杯 b.500mL容量瓶 c.玻璃棒 d.滴定管
(2)已知不同杂质离子开始沉淀和沉淀完全的pH如下:

加入NH3·H2O调节pH=8可除去_______ (填离子符号),此时,溶液中该离子的浓度为_______mol·L-1。加入NaOH调pH=12.5,溶液内剩余的阳离子中_______完全沉淀,_____________ (填离子符号)部分沉淀。加入H2C2O4时应避免过量,原因是___________。(已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9, Ksp[Fe(OH)3] =2.6×10-39)
查看答案和解析>>
科目:高中化学 来源: 题型:
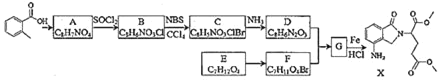
【题目】某研究小组拟合成医药中间体X和Y。
已知:①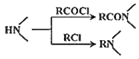 ;②
;②![]() ;③
;③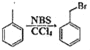
请回答:
(1)下列说法正确的是___。
A.化合物A不能使酸性KMnO4溶液褪色
B.化合物C能发生加成、取代、消去反应
C.化合物D能与稀盐酸发生反应
D.X的分子式是C15H18N2O5
(2)化合物B的结构简式是___。
(3)写出D+F→G的化学方程式___。
(4)写出化合物A(C8H7NO4)同时符合下列条件的同分异构体的结构简式___。
①分子是苯的二取代物,1H﹣NHR谱表明分子中有4种化学环境不同的氢原子
②分子中存在硝基和![]() 结构
结构
(5)设计E→Y(![]() )的合成路线(用流程图表示,无机试剂任选)___。
)的合成路线(用流程图表示,无机试剂任选)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能。图乙为电解氯化铜溶液的实验装置的一部分。下列说法中不正确的是
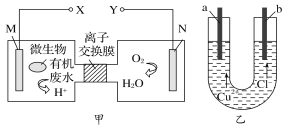
A. a极应与X连接
B. N电极发生还原反应,当N电极消耗11.2 L(标准状况下) O2时,则a电极增重64 g
C. 不论b为何种电极材料,b极的电极反应式一定为2Cl--2e-=Cl2↑
D. 若废水中含有乙醛,则M极的电极反应为:CH3CHO+3H2O-10e-=2CO2↑+10H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )
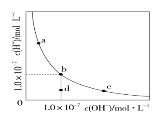
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度下,纯水中的c(H+)=2.0×10-7mol·L-1,则此时溶液的c(OH-)=________ mol·L-1;若温度不变,滴入稀盐酸使c(H+)=5.0×10-6 mol·L-1,则c(OH-)=_________ mol·L-1。
(2)在2mL 0.1mol·L-1的NaCl溶液中,加入2mL 0.1mol·L-1的AgNO3溶液,可观察到白色沉淀生成。将此混合液过滤,向滤渣中加入2mL 0.1mol·L-1的KI溶液,搅拌,可观察到_______________, 反应的离子方程式为______________________。
(3)下列说法不正确的是_____________。
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
B.所有物质的溶解都是吸热的
C.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全
D.除去溶液中的Mg2+,用OH-沉淀Mg2+比![]() 用效果好,说明 Mg(OH)2的溶解度比MgCO3大
用效果好,说明 Mg(OH)2的溶解度比MgCO3大
(4)25 ℃,两种常见酸的电离常数如下表所示。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①![]() 的电离常数表达式 K =_____________。
的电离常数表达式 K =_____________。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是

A. WZ的水溶液呈碱性
B. 元素非金属性的顺序为X>Y>Z
C. Y的最高价氧化物的水化物是中强酸
D. 该新化合物中Y不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X、Y、Z、E为前四周期元素,且原子序数依次增大。A原子核外有三个能级,且每个能级上的电子数相等,C原子成对电子数是未成对电子数的3倍,X、Y、Z、E是位于同一周期的金属元素,X、E原子的最外层电子数均为1,Y有“生物金属”之称,Y4+和氩原子的核外电子排布相同,Z原子核外电子的运动状态数目是最外层电子数的14倍。用元素符号回答下列问题:
(1)B的电子排布式:_____________,Y的价电子排布图____________,Z2+的价电子排布式____________。
(2)E元素位于周期表第________周期__________族_________区。
(3)①A、B、C三种元素的第一电离能由小到大的顺序为_____________。
②A、C元素气态氢化物的稳定性的大小_________>________(分子式表示)原因_____________。
③与AC32-互为等电子体的离子_______(写一种),写出与ABC-离子互为等电子体的分子的化学式:______(写一种)。
④AC2的电子式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,探讨温度对反应的影响,实验结果如下图所示(注:T1,T2均大于300 ℃),下列说法正确的是 ( )。
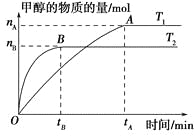
A.温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
B.该反应在T1时的平衡常数比T2时的小
C.该反应为吸热反应
D.处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com