
科目: 来源: 题型:
【题目】25℃时,水溶液中c(H+)与c(OH-)的变化关系如图中曲线a c所示,下列判断错误的是

A.a c曲线上的任意一点都有c(H+)·c(OH-)=10-14
B.b d线段上任意一点对应的溶液都呈中性
C.d点对应溶液的温度高于25℃,pH<7
D.CH3COONa溶液不可能位于c点
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中能大量共存的是( )
A.pH =1的溶液中:NH4+、SO42-、ClO-、Na+
B. 的溶液中:Na+、K+、MnO4-、HCO3-
的溶液中:Na+、K+、MnO4-、HCO3-
C.0.1molL-1的Na2SO3溶液中:H+、K+、SO42-、NO3-
D.澄清透明的溶液中:Fe3+、Na+、Cl-、SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙三个容器中最初存在的物质及其数量如图所示,三个容器最初的容积相等、温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是
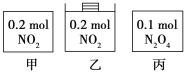
A.平衡时各容器内c(NO2)的大小顺序为乙>甲>丙
B.平衡时N2O4的百分含量:乙>甲=丙
C.平衡时甲中NO2与丙中N2O4的转化率不可能相同
D.平衡时混合物的平均相对分子质量:甲>乙>丙
查看答案和解析>>
科目: 来源: 题型:
【题目】某种碳酸饮料中主要含柠檬酸、碳酸、白砂糖、苯甲酸钠等成分,常温下测得其pH约为![]() ,下列说法不正确的是
,下列说法不正确的是![]()
A.柠檬酸的电离会抑制碳酸的电离
B.该碳酸饮料中水的电离受到抑制
C.常温下,该碳酸饮料中![]() 的值大于纯水中
的值大于纯水中![]() 的值
的值
D.打开瓶盖冒出大量气泡,是因为压强减小,降低了![]() 的溶解度
的溶解度
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,向一个容积可变的容器中,通入3 mol SO2和2 mol O2及固体催化剂,使之发生反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=—196.6 kJ·mol-1,一段时间后达到平衡,平衡时容器内气体总的物质的量为起始时的90%.下列说法正确的是 ( )
2SO3(g) ΔH=—196.6 kJ·mol-1,一段时间后达到平衡,平衡时容器内气体总的物质的量为起始时的90%.下列说法正确的是 ( )
A.达到平衡时SO2的转化率约为33.3%
B.达到平衡时反应放出的热量为294.9 kJ
C.平衡时SO3的物质的量为2mol
D.达平衡时用O2表示的反应速率为0.25 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】平衡体系mA(g)+nB(g)![]() pC(g)+qD(g)有下列判断:①温度不变时,将容器体积增大一倍,若A的浓度变为原来的0.48倍,则m+n>p+q②若平衡时A和B的转化率相等,说明起始时A和B的物质的量之比为m:n③若改变一个条件使反应重新达到平衡时,D的浓度增大了,说明平衡向右移动了④若平衡体系中A、B、C、D的物质的量分别为a、b、c、dmol,则再向其中加入a、b、c、dmol的A、B、C、D时,平衡可能不移动⑤若平衡后降低温度,该反应的化学反应平衡常数增大,说明该反应的ΔH>0,其中正确的是( )
pC(g)+qD(g)有下列判断:①温度不变时,将容器体积增大一倍,若A的浓度变为原来的0.48倍,则m+n>p+q②若平衡时A和B的转化率相等,说明起始时A和B的物质的量之比为m:n③若改变一个条件使反应重新达到平衡时,D的浓度增大了,说明平衡向右移动了④若平衡体系中A、B、C、D的物质的量分别为a、b、c、dmol,则再向其中加入a、b、c、dmol的A、B、C、D时,平衡可能不移动⑤若平衡后降低温度,该反应的化学反应平衡常数增大,说明该反应的ΔH>0,其中正确的是( )
A.②④B.②③C.①④⑤D.①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol·L-1·min-1,且此时A、B的物质的量浓度之比为2∶3。下列说法错误的是
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol·L-1·min-1,且此时A、B的物质的量浓度之比为2∶3。下列说法错误的是
A.x的值是2
B.开始时B的物质的量为3mol
C.5min时,B的物质的量浓度为1.5 mol·L-1
D.5min时,容器中气体总的物质的量为7mol
查看答案和解析>>
科目: 来源: 题型:
【题目】在某温度时,将nmol/L的氨水滴入10mL0.1mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是

A.a点KW=1.0×10-14
B.水的电离程度:b>c>a>d
C.b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.25℃时,一水合氨的电离平衡常数为10-7/(10n-1)(用n表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通入乙烷和氧气,其电极反应式为:C2H6+18OH- –14e-→2CO![]() +12H2O、7H2O+7/2O2+14e-→14OH-,有关此电池的推断正确的是( )
+12H2O、7H2O+7/2O2+14e-→14OH-,有关此电池的推断正确的是( )
A.通氧气的电极为负极
B.参加反应的氧气与C2H6的物质的量之比为7∶2
C.放电一段时间后,KOH的物质的量浓度不变
D.电解质溶液中,CO![]() 向正极移动
向正极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙两同学,均用惰性电极电解相同浓度的硫酸铜溶液,各通电一段时间后,甲、乙分别向所得的溶液中加入0.1 mol CuO和0.1 mol Cu(OH)2,都恰好使溶液恢复到电解前的浓度。则甲、乙在电解过程中转移的电子的物质的量之比为( )
A.1∶1B.1∶2C.1∶3D.1∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com