
科目: 来源: 题型:
【题目】某公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。其中B电极的电极材料为碳,如图是一个电化学过程的示意图。请填空:
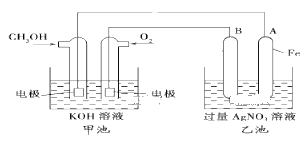
(1)充电时,原电池的负极与电源___极相连。乙池中阳极的电极反应为___。
(2)放电时:负极的电极反应式为___。
(3)在此过程中若完全反应,乙池中A极的质量增加648 g,则甲池中理论上消耗O2___L(标准状况下)。
(4)若在常温常压下,1gCH3OH燃烧生成CO2和液态H2O时放热22.68kJ,表示甲醇燃烧热的热化学方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某两种气态烃组成的混合物,取其2.24L(标准状况下)充分燃烧,得到0.16mol二氧化碳气体和3.6g液态水.据此判断下列分析中不正确的是
A. 此混合气体中可能含有乙烷
B. 此气体中一定含有甲烷
C. 此混合气体中一定不含有丙烷
D. 此气体若是乙烯与甲烷的混合气体,则甲烷与乙烯的体积比为2:3
查看答案和解析>>
科目: 来源: 题型:
【题目】酸、碱、盐都属于电解质,是工业生产、科研领域的重要原料,请按要求回答下列问题:
(1)现有四种稀溶液,分别是:A.硫酸溶液 B.甲酸溶液 C. NaOH溶液 D.氨水
取其中两种溶液发生中和反应,请选择合适的对象完成题目的解答:
①A和C的稀溶液发生中和反应生成1mol水时,放出57.3kJ的热量,请写出此中和反应的热化学方程式______________________________.
②酸碱中和滴定时,须选择合适的指示剂,下列酸碱组合进行滴定时,不能选择甲基橙为指示剂是____(选填字母)
a.A和C b.A和D c. B和 C d. B和D
③B中甲酸的用途之一是用于配制“缓冲溶液”(HCOOH~HCOONa)。请写出甲酸电离方程式___________________________;已知一定温度下,甲酸的电离平衡常数 Ka=1.8×10-4,若用 0.2mol·L-1HCOOH 溶液100mL配制pH为4的缓冲溶液,需加入_______mL(答案保留一位小数) 0.2mol· L-1NaOH溶液。
(2)砷(As)是一些工厂和矿山废水中的污染元素,H3AsO3(亚砷酸)和H3AsO4(亚砷酸)水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度总和的比值)与pH关系分别如图所:
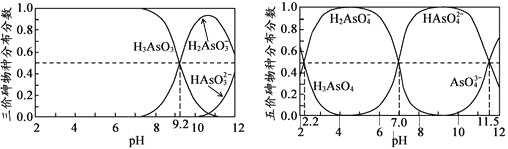
①以酚酞为指示剂,将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加,此时砷元素的主要存在形式为________________(填微粒的化学式)②已知 pKa1 = —lgKa1
H3AsO4第一步电离方程式为H3AsO4![]() H2AsO4- + H+ 电离常数为Ka1,则pKa1=______。
H2AsO4- + H+ 电离常数为Ka1,则pKa1=______。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素铬![]() 在溶液中主要以
在溶液中主要以![]() 蓝紫色
蓝紫色![]() 、
、![]() 绿色
绿色![]() 、
、![]() 橙红色
橙红色![]() 、
、![]() 黄色
黄色![]() 等形式存在,
等形式存在,![]() 为难溶于水的灰蓝色固体,回答下列问题:
为难溶于水的灰蓝色固体,回答下列问题:
(1)![]() 与
与![]() 的化学性质相似,在
的化学性质相似,在![]() 溶液中逐滴加入NaOH溶液直至过量,可察到的现象是 ______________________________________________ .
溶液中逐滴加入NaOH溶液直至过量,可察到的现象是 ______________________________________________ .
(2)![]() 和
和![]() 在溶液中可相互转化
在溶液中可相互转化![]() 室温下,初始浓度为
室温下,初始浓度为![]() 的
的![]() 溶液中
溶液中![]() 随
随![]() 的变化如图所示.
的变化如图所示.

![]() 用离子方程式表示
用离子方程式表示![]() 溶液中的转化反应______________________________ .
溶液中的转化反应______________________________ .
![]() 由图可知,溶液酸性增大,
由图可知,溶液酸性增大,![]() 的平衡转化率__________________
的平衡转化率__________________ ![]() 填“增大“减 小”或“不变”
填“增大“减 小”或“不变”![]() 根据A点数据,计算出该转化反应的平衡常数为 _______________ .
根据A点数据,计算出该转化反应的平衡常数为 _______________ .
![]() 升高温度,溶液中
升高温度,溶液中![]() 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的![]() ______
______ ![]() 填“大于”“小于”或“等于”
填“大于”“小于”或“等于”![]() .
.
(3)在化学分析中采用![]() 为指示剂,以
为指示剂,以![]() 标准溶液滴定溶液中的
标准溶液滴定溶液中的![]() ,利用
,利用![]() 与
与![]() 生成砖红色沉淀,指示到达滴定终点
生成砖红色沉淀,指示到达滴定终点![]() 当溶液中
当溶液中![]() 恰好完全沉淀
恰好完全沉淀![]() 浓度等于
浓度等于![]() 时,溶液中
时,溶液中![]() 为 ______
为 ______ ![]() ,此时溶液中
,此时溶液中![]() 等于 ______
等于 ______ ![]() 已知
已知![]() 、AgCl的
、AgCl的![]() 分别为
分别为![]() 和
和![]()
(4)![]() 价铬的化合物毒性较大,常用
价铬的化合物毒性较大,常用![]() 将废液中的
将废液中的![]() 还原成
还原成![]() ,反应的离子方程式为 _________________________________________________ .
,反应的离子方程式为 _________________________________________________ .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A. 1mol甲基含10NA个电子
B. 15 g C2H6中含有共价键数目为3NA
C. 标准状况下,11.2 L三氯甲烷所含的分子数目为0.5NA
D. 一定条件下,2.6 g苯和苯乙烯的混合物完全燃烧消耗O2的分子数为0.25NA
查看答案和解析>>
科目: 来源: 题型:
【题目】最近雾霾天气肆虐我国大部分地区。其中![]() 是造成空气污染的主要原因,利用钠碱循环法可除去
是造成空气污染的主要原因,利用钠碱循环法可除去![]() 。
。
![]() 钠碱循环法中,吸收液为
钠碱循环法中,吸收液为![]() 溶液中各离子浓度由大到小的顺序为_____________。
溶液中各离子浓度由大到小的顺序为_____________。
![]() 溶液吸收
溶液吸收![]() 反应的离子方程式是__________________________________。
反应的离子方程式是__________________________________。
![]() 已知
已知![]() 的电离常数为
的电离常数为![]() ,
,![]() ;
;![]() 的电离常数为
的电离常数为![]() ,
,![]() ,则下列微粒可以大量共存的是______
,则下列微粒可以大量共存的是______![]() 填序号
填序号![]() 。
。
A.![]() 和
和![]()
![]() 和
和![]()
![]() 和
和![]()
![]() 和
和![]()
![]() 吸收液吸收
吸收液吸收![]() 的过程中,水溶液中
的过程中,水溶液中![]() 、
、![]() 、
、![]() 随pH的分布如图:
随pH的分布如图:

![]() 吸收
吸收![]() 制备
制备![]() 溶液,实验中确定何时停止通
溶液,实验中确定何时停止通![]() 的实验操作为_________________。
的实验操作为_________________。
![]() 在
在![]() 溶液中离子浓度关系不正确的是_______
溶液中离子浓度关系不正确的是_______![]() 填序号
填序号![]() 。
。
A.![]()
![]()
C.![]()
![]()
![]() 亚硫酰氯
亚硫酰氯![]() 又名氯化亚砜,是一种液态的非电解质,沸点为
又名氯化亚砜,是一种液态的非电解质,沸点为![]() 。
。![]() 中氯元素与硫元素直接以共价键相连,其中Cl呈
中氯元素与硫元素直接以共价键相连,其中Cl呈![]() 价;
价;![]() 遇水可生成
遇水可生成![]() 。请回答下列问题:蒸干
。请回答下列问题:蒸干![]() 溶液不能得到无水
溶液不能得到无水![]() ,若将
,若将 ![]() 与
与![]() 混合并加热,可制得无水
混合并加热,可制得无水![]() ,请用
,请用 ![]() 与水反应的方程式和必要的文字描述解释原因________________________________________________________。
与水反应的方程式和必要的文字描述解释原因________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有常温下浓度均为![]() 的下列5种溶液:
的下列5种溶液:![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液
![]() 这5种溶液pH由大到小的顺序是________________,其中由水电离的
这5种溶液pH由大到小的顺序是________________,其中由水电离的![]() 浓度最小的是______。
浓度最小的是______。![]() 填序号
填序号![]()
![]() 中各离子浓度由大到小的顺序是________________________________________________________,
中各离子浓度由大到小的顺序是________________________________________________________,![]() 的水解平衡常数
的水解平衡常数![]() _________________。
_________________。![]() 已知碳酸的电离常数
已知碳酸的电离常数![]() ,
,![]()
![]() 向
向![]() 中通入少量氨气,此时
中通入少量氨气,此时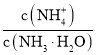 的值__________
的值__________![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
![]() 若将
若将![]() 和
和![]() 混合后溶液恰好呈中性,则混合前
混合后溶液恰好呈中性,则混合前![]() 的体积______
的体积______![]() 的体积
的体积![]() 填“大于”、“小于”或“等于”
填“大于”、“小于”或“等于”![]() 。
。
![]() 将
将![]() 的溶液分别蒸干并灼烧,最终可得原溶质的是____________
的溶液分别蒸干并灼烧,最终可得原溶质的是____________![]() 填序号
填序号![]() 。
。
![]() 一定量的稀
一定量的稀![]() 溶液与足量的Zn反应,为减缓产生的
溶液与足量的Zn反应,为减缓产生的![]() 速率但又不影响
速率但又不影响![]() 的总量,可采取的措施是______
的总量,可采取的措施是______![]() 填字母
填字母![]() 。
。
A.加![]() 固体
固体![]() 加
加![]() 固体
固体![]() 加
加![]() 溶液
溶液![]() 加氨水
加氨水![]() 加
加![]() 溶液
溶液
![]() 常温下,向
常温下,向![]() 溶液中加入
溶液中加入![]() 溶液,可观察到的现象是_______________________________________,发生反应的离子方程式为______________________________,若将所得悬浊液的pH值调整为4,则溶液中
溶液,可观察到的现象是_______________________________________,发生反应的离子方程式为______________________________,若将所得悬浊液的pH值调整为4,则溶液中![]() 的溶液为_____
的溶液为_____![]()
![]() 已知常温下
已知常温下![]() 。
。
![]() 等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 ____________ 性,溶液中
等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 ____________ 性,溶液中![]() __________
__________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ;
;![]() 的氢氧化钠与
的氢氧化钠与![]() 的醋酸等体积混合后溶液呈__________________性,溶液中
的醋酸等体积混合后溶液呈__________________性,溶液中![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ;
;
![]() 常温下,用
常温下,用![]() 溶液滴定
溶液滴定![]() 某一元酸HA溶液所得滴定曲线如图.
某一元酸HA溶液所得滴定曲线如图.
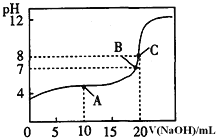
![]() A、B、C三点所示溶液导电能力最强的是 ______ 点对应的溶液;
A、B、C三点所示溶液导电能力最强的是 ______ 点对应的溶液;
![]() 点的离子浓度大小关系是 ________________________________ .
点的离子浓度大小关系是 ________________________________ .
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种优良的水处理剂。25℃,其水溶液中加酸或碱改变溶液的pH时,含铁粒子的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)=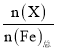 ]。下列说法正确的是( )
]。下列说法正确的是( )

A.K2FeO4、H2FeO4都属于强电解质
B.25℃,H2FeO4+H+![]() H3FeO4+的平衡常数K>100
H3FeO4+的平衡常数K>100
C.由B点数据可知,H2FeO4的第一步电离常数Ka1=4.15×10-4
D.A、C两点对应溶液中水的电离程度相等
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)25℃时,用0.10 mol/L的氨水滴定10.00 mL 0.05 mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

A. H2A的电离方程式为H2A![]() H++HA -
H++HA -
B. B点溶液中,水电离出的氢离子浓度为1.0×10-6 mol/L
C. C点溶液中,c(NH4+)+c(NH3·H2O)= 2c(A2-)
D. 25℃时,该氨水的电离平衡常数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com