
科目: 来源: 题型:
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气,反应为:C(S) + H2O(g)![]() CO(g) + H2(g) △H = + 131.3 kJ·mol-1一定温度下,在一个容积可变的容器中,发生上述反应,能确定该反应达到化学平衡状态的是_______________ (填标号)。
CO(g) + H2(g) △H = + 131.3 kJ·mol-1一定温度下,在一个容积可变的容器中,发生上述反应,能确定该反应达到化学平衡状态的是_______________ (填标号)。
A.容器中的压强不变
B.1mol H—H键断裂的同时断裂2mol H—O键
C.v正(H2O) = v逆(H2O)
D.c(CO) = c(H2)
(2)一定条件下,利用CO与H2。反应可制得甲醇:CO(g) +2H2(g) ![]() CH3OH (g)图1表示该反应进行过程中的能量变化,图2表示一定温度下,在体积为2L的密闭容器中加入4 molH2和一定量的CO后,CO和CH3OH的浓度随时间变化情况。
CH3OH (g)图1表示该反应进行过程中的能量变化,图2表示一定温度下,在体积为2L的密闭容器中加入4 molH2和一定量的CO后,CO和CH3OH的浓度随时间变化情况。
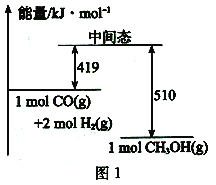
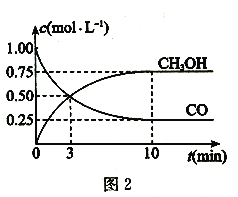
①根据图l,写出在该条件下CO制备甲醇气体的热化学方程式:___________。
②根据图2,计算该温度下反应CO(g) + 2H2(g) ![]() CH3OH (g)的平衡常数为____。
CH3OH (g)的平衡常数为____。
③以甲醇为燃料的新型燃料电池,正极通入O2,负极通入CH3OH,在KOH溶液中CH3OH与O2作用生成H2O和K2CO3 。 写出正极的电极反应式____________;放电时,OH-移向电池的_________(填“正”或“负")极。
(3)氯化铵溶液因NH4+离子水解使溶液呈______性,要使氯化铵溶液变为中性又不引入新杂质应选用_________(填“盐酸”或“氨水"或“氢氧化钠")。
(4)现有25℃时,pH=13的Ba(OH )2溶液。求:
① 该Ba(OH)2溶液中OH-的物质的量浓度为_____________________。
② 该Ba(OH)2溶液的物质的量浓度为_____________________。
(5)用惰性电极电解Cu(NO3)2溶液时,如果阴极上有1.92g铜析出,则阳极上产生气体的体积(标准状况下)约为____________L。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展做出巨大贡献的科学家,锂离子电池广泛应用于手机、笔记本电脑等。
(1)锂元素在元素周期表中的位置:_________________。
(2)氧化锂(Li2O)是制备锂离子电池的重要原料,氧化锂的电子式为_____________。
(3)近日华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出了石墨烯电池,电池反应式为LIxC6+Li1-x![]() C6+LiCoO2,其工作原理如图。
C6+LiCoO2,其工作原理如图。

①石墨烯的优点是提高电池的能量密度,石墨烯为层状结构,层与层之间存在的作用力是_______。
②锂离子电池不能用水溶液做离子导体的原因是___________(用离子方程式表示)。
③锂离子电池放电时正极的电极反应式为________________。
④请指出使用锂离子电池的注意问题____________________。(回答一条即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:pNi= -lg c(Ni2+),常温下H2S的电离平衡常数:Kal=l. 3×10-7,Ka2=7. 1×10-15。常温下,向10 mL 0. 1 molL-1Ni(NO3)2溶液中滴加0.1 molL-1Na2S溶液,滴加过程中pNi与Na2S溶液体积的关系如图所示。下列说法正确的是
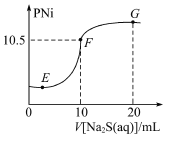
A.E、F、G三点中,F点对应溶液中水电离程度最大
B.常温下,Ksp(NiS) = 1×10-21
C.Na2S溶液中 c(S2- )+c(HS- )+c(H2S) =c(Na+)
D.Na2S溶液中,S2-第一步水解常数Kh1=![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为:正极:_____________________________ ;负极:______________________。
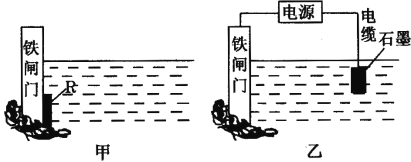
(2)为了降低某水库铁闸门被腐蚀的速率,可以采用甲图所示的方案,其中焊接在闸 门上的固体材料R可以采用___________。
A.铜 B.钠 C.锌 D.石墨
(3)乙图所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的___________极。
(4)铅蓄电池是化学电源,其电极材料分别为Pb和PbO2,电解质溶液为稀硫酸,放电时电池的总反应为Pb + PbO2 + 2H2SO4== 2PbSO4 + 2H2O。根据上述情况判断:
①铅蓄电池的正极材料是_______(填“Pb”或“PbO2”),负极的电极反应式为_______________________________________。
②铅蓄电池工作时,电解质溶液中SO42﹣移向________极(填“负”或“正”),溶液的pH___________ (填“增大”“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列物质中选择合适的完成下列各题。
①稀硝酸;②CO;③HF;④熔融NaHSO4;⑤CaO;⑥Cu;⑦蔗糖;⑧Fe2(SO4) 3;⑨酒精;⑩硫酸钡;醋酸;三氧化硫;氯气;醋酸钠
(1) 属于强电解质的是____________________(填序号,下同) 。
(2) 属于弱电解质的是____________________。
(3) 属于非电解质的是_____________________。
(4) 写出③、两种物质在水溶液中的电离方程式:③___________________________;_________________________________。
(5) 醋酸钠溶液显_________性(填酸或碱)的原因:______________________________________________________________ (用离子方程式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常用电解对含氮生活污水进行处理。若污水中含有Cl-,主要靠有效氯(HC1O、ClO-)将NH4+氧化为N2。其工作原理如图所示,下列分析正确的是
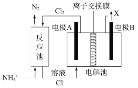
A.电极A为阴极
B.电极B上发生电极反应:2H++2e-=H2↑
C.电解池中离子交换膜为阴离子交换膜
D.处理含l mol NH4+的废水,反应池中共转移电子数目为3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为1 L的密闭容器中,投入1 mol N2和3 mol H2分别在以下不同实验条件下进行反应。下列分析正确的是
容器编号 | 实验条件 | 平衡时反应中的能量变化 |
I | 恒温恒容 | 放热Q1kJ |
II | 恒温恒压 | 放热Q2kJ |
Ⅲ | 恒容绝热 | 放热Q3kJ |
A.放出热量:Q1<Q2B.N2的转化率:I>Ⅲ
C.平衡常数:II>ID.平衡时氨气的体积分数:I>II
查看答案和解析>>
科目: 来源: 题型:
【题目】MnSO4H2O是一种易溶于水的微红色斜方晶体,某同学设计下列装置制备硫酸锰:下列说法错误的是
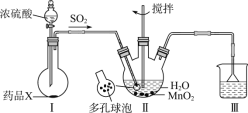
A.装置I烧瓶中放入的药品X为Na2SO3
B.装置II中用“多孔球泡”可增大SO2的吸收速率
C.装置Ⅲ烧杯中溶液为饱和NaHSO3
D.用装置II反应后的溶液制备MnSO4H2O需经历蒸发浓缩、冷却结晶、过滤洗涤干燥等过程
查看答案和解析>>
科目: 来源: 题型:
【题目】I-具有还原性,含碘食盐中的碘元素主要以KIO3的形式存在,I-、I2、IO3-在一定条件下可发生如图转化关系,下列说法不正确的是
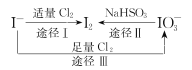
A.用淀粉-KI试纸和食醋可检验食盐是否加碘
B.由图可知氧化性的强弱顺序为Cl2>IO3->I2
C.生产等量的碘,途径I和途径II转移电子数目之比为5 :2
D.途径III反应的离子方程式:3Cl2+I-+3H2O=6Cl-+IO3-+6H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com