
【题目】在容积为1 L的密闭容器中,投入1 mol N2和3 mol H2分别在以下不同实验条件下进行反应。下列分析正确的是
容器编号 | 实验条件 | 平衡时反应中的能量变化 |
I | 恒温恒容 | 放热Q1kJ |
II | 恒温恒压 | 放热Q2kJ |
Ⅲ | 恒容绝热 | 放热Q3kJ |
A.放出热量:Q1<Q2B.N2的转化率:I>Ⅲ
C.平衡常数:II>ID.平衡时氨气的体积分数:I>II
【答案】AB
【解析】
A. N2和H2合成氨气的反应方程式为:N2+3H2![]() 2NH3,该反应的正反应为气体体积减小的放热反应,以I为标准,对于反应II,随着反应的进行,容器内气体的压强减小,要保存恒压,就要减小容器的容积,增大了压强,化学平衡正向移动,所以达到平衡时反应放出的热量Q2>Q1,A正确;
2NH3,该反应的正反应为气体体积减小的放热反应,以I为标准,对于反应II,随着反应的进行,容器内气体的压强减小,要保存恒压,就要减小容器的容积,增大了压强,化学平衡正向移动,所以达到平衡时反应放出的热量Q2>Q1,A正确;
B. 对于反应III,由于该反应是放热反应,要保持恒容绝热,反应放热使容器的温度升高,升高温度,化学平衡向吸热的逆反应方向移动,最终达到平衡时反应物N2的转化率I>III,B正确;
C. 化学平衡常数只与温度有关,与其它条件无关。由于I、II温度相同,所以平衡常数相等,C错误;
D. 根据选项A分析可知:反应II相对于I来说就是增大压强。增大压强,化学平衡正向移动,因此达到平衡时氨气的体积分数:I<II,D错误;
故合理选项是AB。


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
【题目】一、(1)硫酸铜晶体的溶解度虽大,但溶解过程较慢,实验室常用热水配制以加快溶解速率,但常常会产生浑浊,请用文字简要说明原因_______________。
(2)稀Na2S溶液有一种腐卵气味,加入AlCl3溶液后,腐卵气味加剧,用离子方程式表示气味加剧过程所发生的化学反应______________。
二、依据氧化还原反应:MnO4-+5Fe2++8H+ = Mn2++5Fe3++4H2O,欲采用滴定的方法测定FeSO4的质量分数,实验步骤如下:①称量绿矾样品,配成100 mL待测溶液,②取一定体积待测液置于锥形瓶中,并加入一定量的硫酸,③将标准浓度的KMnO4溶液装入滴定管中,调节液面至a mL处,④滴定待测液至滴定终点时,滴定管的液面读数b mL,⑤重复滴定2~3次。
(1)如何知道滴定到达终点?__________。下列操作会导致测定结果偏低的是_______。
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失
(2)下列每种量器的数量不限,在上述实验中,必须使用的有____________;
A.托盘天平 B.量筒 C.碱式滴定管 D.酸式滴定管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温时空气中的N2和O2会反应生成NO而污染大气:N2(g)+O2(g)=2NO(g)。试通过计算说明在1 200 ℃的条件下,此反应能否正向自发进行?估算自发进行的最低温度是多少______?[已知该反应:ΔH=+180.50 kJ·mol-1,ΔS=247.7 J·mol-1·K-1]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氨水中存在电离平衡:NH3·H2O ![]() NH4+ + OH-,下列情况能引起电离平衡向右移动的有( )。
NH4+ + OH-,下列情况能引起电离平衡向右移动的有( )。
①加NH4Cl固体 ②加NaOH溶液 ③通HCl ④加CH3COOH溶液 ⑤加水
A.①③⑤B.①④⑤C.①②④D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为1L的密闭容器中,l molX和1 mol Y进行反应:2X(g)+Y(g) ![]() Z(g),下列叙述能证明该反应已达到化学平衡状态的是( )。
Z(g),下列叙述能证明该反应已达到化学平衡状态的是( )。
A.c(X)∶c(Y)∶c(Z) = 2∶1∶lB.容器内原子总数不再发生变化
C.X的百分含量不再发生变化D.同一时间内消耗2n mol X的同时生成n mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展做出巨大贡献的科学家,锂离子电池广泛应用于手机、笔记本电脑等。
(1)锂元素在元素周期表中的位置:_________________。
(2)氧化锂(Li2O)是制备锂离子电池的重要原料,氧化锂的电子式为_____________。
(3)近日华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出了石墨烯电池,电池反应式为LIxC6+Li1-x![]() C6+LiCoO2,其工作原理如图。
C6+LiCoO2,其工作原理如图。

①石墨烯的优点是提高电池的能量密度,石墨烯为层状结构,层与层之间存在的作用力是_______。
②锂离子电池不能用水溶液做离子导体的原因是___________(用离子方程式表示)。
③锂离子电池放电时正极的电极反应式为________________。
④请指出使用锂离子电池的注意问题____________________。(回答一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知取H2(g)+2ICl(g)=I2(g)+2HCl(g),该反应分①②两步进行,其能量曲线如图所示,下列有关说法正确的是( )
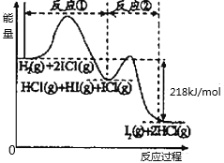
A.反应①为吸热反应
B.反应①和②均是同种元素间发生的氧化还原反应
C.反应①比反应②的速率慢,与相应正反应的活化能有关
D.H2(g) +2ICl(g)=I2(g)+2HCl(g) △H=-218kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应属于阴影3区域的是
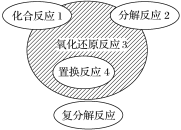
A.2HClO![]() 2HCl+O2↑
2HCl+O2↑
B.NH4HCO3![]() NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3
D.Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1mol·L-1NaOH溶液中加入0.1mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A.b点所示溶液中[A-]>[HA]
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,[Na+]=[A-]+[HA]
D.a点所示溶液中[Na+]>[A-]>[H+]>[HA]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com