
【题目】已知取H2(g)+2ICl(g)=I2(g)+2HCl(g),该反应分①②两步进行,其能量曲线如图所示,下列有关说法正确的是( )
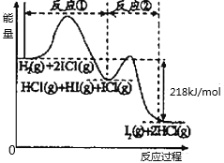
A.反应①为吸热反应
B.反应①和②均是同种元素间发生的氧化还原反应
C.反应①比反应②的速率慢,与相应正反应的活化能有关
D.H2(g) +2ICl(g)=I2(g)+2HCl(g) △H=-218kJ/mol
【答案】C
【解析】
A. 由图像可知,反应①中的反应物的总能量均大于生成物的总能量,为放热反应,故A项错误;
B. 反应①中,氢元素化合价变化:0→+1,碘元素化合价变化:+1→-1;反应②中,HI中碘元素化合价变化:-1→0,ICl中碘元素化合价变化:+1→0,所以反应①、反应②不是同种元素间发生的氧化还原反应,故B项错误;
C. 反应①比反应②的速率慢,由图可知,反应①正反应的活化能比反应②的大,活化能越高则活化分子的百分数越小,化学反应速率越慢,故反应速率与相应正反应的活化能有关,故C项正确;
D. 焓变只与体系的始、末状态有关,而与反应的途径无关,由图像可知,反应前后总的能量变化为218 kJ/mol,所以反应①、反应②的焓变之和为△H=-218 kJ/mol;而H2(g) +2ICl(g)=I2(g)+2HCl(g) 仅是其中的一步反应,所以△H>-218 kJ/mol;故D项错误;
综上所述,本题选C。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+HI(g)
H2(g)+HI(g)
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下,反应①的平衡常数为
A.9B.16C.20D.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、硫的化合物在生产生活中广泛存在。请回答:
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH=-160.5 kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
写出CO2与NH3合成尿素和气态水的热化学反应方程式____________。
(2)T1温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)![]() 2NO2(g) H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),
2NO2(g) H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),
k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①从0~2s该反应的平均速率v(NO2)=___________。
②T1温度时化学平衡常数K=___________mol-1·L。
③化学平衡常数K与速率常数k正、k逆的数学关系是K=___________。若将容器的温度改变为T2时其k正=k逆,则T1__________T2 (填“>”、“<”或“=”)。
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是____________________(写出主要反应的离子方程式),该溶液中,c(Na+)______2c(SO32-)+c(HSO3-)(填“>”“<”或“=”)。
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO32-的第一步水解平衡常数=________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1 L的密闭容器中,投入1 mol N2和3 mol H2分别在以下不同实验条件下进行反应。下列分析正确的是
容器编号 | 实验条件 | 平衡时反应中的能量变化 |
I | 恒温恒容 | 放热Q1kJ |
II | 恒温恒压 | 放热Q2kJ |
Ⅲ | 恒容绝热 | 放热Q3kJ |
A.放出热量:Q1<Q2B.N2的转化率:I>Ⅲ
C.平衡常数:II>ID.平衡时氨气的体积分数:I>II
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时CH3COOH的电离常数K=1.6×10-5。该温度下向20ml0.01mol/L CH3COOH溶液中逐滴加入0.01mol/LKOH溶液,其pH变化曲线如图所示(忽略温度和溶液体积的变化),下列说法正确的是( )
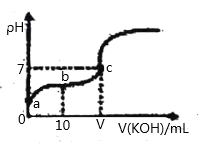
A.a点溶c(H+)为4.0×10-5mol/L
B.b点溶液中满足c(CH3COO-) +c(OH-)=c(CH3COOH)+c(H+)
C.V=20
D.滴定过程中,c(CH3COO-)+c(CH3COOH)+c(K+)=0.01mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的两种氧化物在化工生产中都有着重要的用途。
I.CuO可用于制备Cu2O。
已知:①2Cu2O(s)![]() 4Cu(s)+O2(g) △H1=+338kJ·mol-1;
4Cu(s)+O2(g) △H1=+338kJ·mol-1;
②2CuO(s)![]() 2Cu(s)+O2(g) △H2=+314kJ·mol-1。
2Cu(s)+O2(g) △H2=+314kJ·mol-1。
(1)CuO分解生成2molCu2O的热化学方程式为___。
(2)温度为T时,向5L恒容密闭容器中加入80gCuO制备Cu2O,5min时恰好达到平衡,测得容器中Cu2O的物质的量为0.4mol。
①该反应的平衡常数K=___。
②5min时缩小容器容积,重新达到平衡时O2的浓度___(填“增大”、“减小”或“不变”)。
(3)研究表明,在CuO中加入适量碳粉有利于制得纳米级Cu2O,下列说法正确的是___(填选项字母)。
A.碳与氧气反应放热,加快反应速率 B.生成CO气体,使固体颗粒容易分散
C.CO可以将Cu2O还原为铜粉 D.CO作该反应的催化剂
Ⅱ.CuO可用于冶炼铜(已知:CO的燃烧热△H=—283kJ·mol-1);一定条件下,将1molCuO和0.5molCO加入2L密闭容器中发生反应,t1时达到平衡,t2后改变容器中的条件,用CO表示的反应速率(v)与时间(t)的关系如图所示(三个阶段改变的条件为温度、压强、浓度中的一个)。
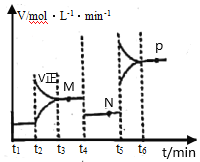
(4)t4时改变的条件为___。
(5)M、N、P三点对应状态下,CO的转化率a(M)、a(N)、a(P)的大小关系为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101 ℃,易溶于水,受热脱水、升华,170 ℃以上分解。回答下列问题:

(1)装置C中可观察到的现象是_________________________________,装置B的主要作用是________。
(2)请设计实验验证草酸的酸性比碳酸强____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖
B.室温下,将![]() HA溶液和
HA溶液和![]() 溶液等体积混合
溶液等体积混合![]() 忽略体积的变化
忽略体积的变化![]() 测得混合溶液的
测得混合溶液的![]() ,则混合溶液中由水电离出的
,则混合溶液中由水电离出的![]()
C.纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于![]() 时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同素异形体
时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同素异形体
D.已知![]() 的
的![]() 为
为![]() ,则将等体积的
,则将等体积的![]()
![]() 的
的![]() 溶液和
溶液和![]()
![]()
![]() 溶液混合后会有
溶液混合后会有![]() 沉淀产生
沉淀产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com