
【题目】碳、氮、硫的化合物在生产生活中广泛存在。请回答:
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH=-160.5 kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
写出CO2与NH3合成尿素和气态水的热化学反应方程式____________。
(2)T1温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)![]() 2NO2(g) H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),
2NO2(g) H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),
k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①从0~2s该反应的平均速率v(NO2)=___________。
②T1温度时化学平衡常数K=___________mol-1·L。
③化学平衡常数K与速率常数k正、k逆的数学关系是K=___________。若将容器的温度改变为T2时其k正=k逆,则T1__________T2 (填“>”、“<”或“=”)。
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是____________________(写出主要反应的离子方程式),该溶液中,c(Na+)______2c(SO32-)+c(HSO3-)(填“>”“<”或“=”)。
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO32-的第一步水解平衡常数=________。

【答案】2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H=-276.0kJ/mol 0.0875 mol/(L·s) 8 k正/k逆 < SO32-+H2OHSO3-+OH- > 10-6.8
【解析】
(1)依据热化学方程式和盖斯定律计算①+②+③得到CO2与NH3合成尿素和气态水的热化学反应方程式;
(2)①根据v=![]() 计算出前5s内v(NO2);
计算出前5s内v(NO2);
②
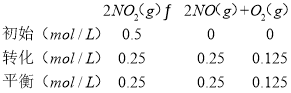
根据化学平衡常数K1=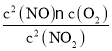 计算K1,进而计算2NO(g)+O2(g)2NO2(g)化学平衡常数K=
计算K1,进而计算2NO(g)+O2(g)2NO2(g)化学平衡常数K=![]() ;
;
③2NO(g)+O2(g)2NO2(g)化学平衡常数K=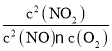 ,化学反应达到平衡时v正=v逆,即k正c2(NO)c(O2)=k逆c2(NO2),则
,化学反应达到平衡时v正=v逆,即k正c2(NO)c(O2)=k逆c2(NO2),则![]() =
=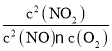 ;结合平衡常数K与反应的热效应判断温度高低。
;结合平衡常数K与反应的热效应判断温度高低。
(3)①亚硫酸根离子水解导致溶液显示碱性,根据电荷守恒确定离子浓度的关系;
②根据水解平衡常数表达式结合图中数据来计算。
(1)①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJmol-1,②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l)△H=-160.5kJmol-1,③H2O(l)=H2O(g)△H=+44.0kJmol-1,依据热化学方程式和盖斯定律计算①+②+③得到CO2与NH3合成尿素和气态水的热化学反应方程式为2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)△H=-276.0KJ/mol;
(2)①根据表中数据计算出前2s内v(NO2)=![]() =
=![]() =
=![]() =0.0875mol/(Ls);
=0.0875mol/(Ls);
②
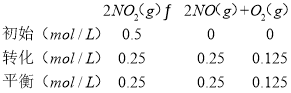
根据化学平衡常数K1=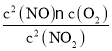 =
=![]() =0.125,所以2NO(g)+O2(g)2NO2(g)化学平衡常数K=
=0.125,所以2NO(g)+O2(g)2NO2(g)化学平衡常数K=![]() =8;
=8;
③2NO(g)+O2(g)2NO2(g)化学平衡常数K=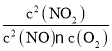 ,化学反应达到平衡时v正=v逆,即k正c2(NO)c(O2)=k逆c2(NO2),则
,化学反应达到平衡时v正=v逆,即k正c2(NO)c(O2)=k逆c2(NO2),则![]() =
=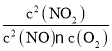 =K,即K=
=K,即K=![]() ;温度改变为T2时其k正=k逆,则T2时化学平衡常数K=1,小于T1温度时化学平衡常数K=8,即T1→T2时,平衡逆向移动,而2NO(g)+O2(g)2NO2(g)△H<0,所以温度改变是升高温度,T1<T2;
;温度改变为T2时其k正=k逆,则T2时化学平衡常数K=1,小于T1温度时化学平衡常数K=8,即T1→T2时,平衡逆向移动,而2NO(g)+O2(g)2NO2(g)△H<0,所以温度改变是升高温度,T1<T2;
(3)①亚硫酸根离子水解导致溶液显示碱性,原理是:SO32-+H2OHSO3-+OH-,所以,该溶液中,c(H+)<c(OH-),根据电荷守恒,则:c(Na+)>2c(SO32-)+c(HSO3-);
②亚硫酸根离子的水解平衡常数K=  ,当pH=7.2时,SO32-、HSO3-浓度相等,所以K=c(OH-)=10-6.8。
,当pH=7.2时,SO32-、HSO3-浓度相等,所以K=c(OH-)=10-6.8。


科目:高中化学 来源: 题型:
【题目】某含氧有机化合物可以作为无铅汽油的抗爆震剂,含C的质量分数为68.2%,含H的质量分数为13.6%。
(1)求出该有机化合物的最简式(要求写出计算过程)。___________
(2)________(填“能”或“不能”)确定该有机化合物的分子式,若能确定,该有机物的分子式为________________,理由是______________
(3)红外光谱和核磁共振氢谱显示该分子中有4个甲基,请写出其结构简式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中离子存在和转化表述不正确的是
A.常温下水电离出的c(H+)=1×1012 mol/L的溶液中不可能大量存在:Al3+、![]() 、Cl、S2
、Cl、S2
B.加入铝粉能产生H2的溶液中可能大量存在:Na+、Cl-、S2-、![]()
C.过量铁粉与稀HNO3反应:3Fe+8H++2![]()
![]() 3Fe2++2NO↑+4H2O
3Fe2++2NO↑+4H2O
D.向AlCl3溶液中滴入大量氨水:Al3++4NH3·H2O![]()
![]() +4
+4![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温时空气中的N2和O2会反应生成NO而污染大气:N2(g)+O2(g)=2NO(g)。试通过计算说明在1 200 ℃的条件下,此反应能否正向自发进行?估算自发进行的最低温度是多少______?[已知该反应:ΔH=+180.50 kJ·mol-1,ΔS=247.7 J·mol-1·K-1]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲是一种利用微生物将废水中的尿素(CO(NH2)2)转化为环境友好物质的原电池装置示意图甲,利用该电池在图乙装置中的铁上镀铜。下列说法正确的是( )

A.图乙中Fe电极应与图甲中Y相连接
B.图甲中H+透过质子交换膜由右向左移动
C.图甲中M电极反应式:CO(NH2)2 +5H2O -14e = CO2+2NO2+14H+
D.当图甲中N电极消耗0.5 mol O2时,图乙中阴极增重64g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氨水中存在电离平衡:NH3·H2O ![]() NH4+ + OH-,下列情况能引起电离平衡向右移动的有( )。
NH4+ + OH-,下列情况能引起电离平衡向右移动的有( )。
①加NH4Cl固体 ②加NaOH溶液 ③通HCl ④加CH3COOH溶液 ⑤加水
A.①③⑤B.①④⑤C.①②④D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为1L的密闭容器中,l molX和1 mol Y进行反应:2X(g)+Y(g) ![]() Z(g),下列叙述能证明该反应已达到化学平衡状态的是( )。
Z(g),下列叙述能证明该反应已达到化学平衡状态的是( )。
A.c(X)∶c(Y)∶c(Z) = 2∶1∶lB.容器内原子总数不再发生变化
C.X的百分含量不再发生变化D.同一时间内消耗2n mol X的同时生成n mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知取H2(g)+2ICl(g)=I2(g)+2HCl(g),该反应分①②两步进行,其能量曲线如图所示,下列有关说法正确的是( )
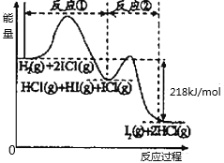
A.反应①为吸热反应
B.反应①和②均是同种元素间发生的氧化还原反应
C.反应①比反应②的速率慢,与相应正反应的活化能有关
D.H2(g) +2ICl(g)=I2(g)+2HCl(g) △H=-218kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下几种弱酸或弱碱的电离平衡常数(Ka或Kb)如下表所示:
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HCN | 5×10-10 |
NH3H2O | 1.8×10-5 |
H2SO3 | K1=1.5×10-2,K2=1.1×10-7 |
回答下列问题:
(1)CH3COONH4的水溶液呈中性,其理由是_____________,溶液中各离子浓度大小的关系是___________________。
(2)等物质的量浓度的下列五种溶液:①NH3H2O ②(NH4)2SO3 ③NaHSO3 ④Na2SO3
⑤H2SO3溶液中水的电离程度由大到小的排列顺序为________(填序号)。
(3)向25 mL 0.10 molL-1盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是________(填字母)。
A.c(Cl-)=c(NH4+)>c(H+)=c(OH-) B. c(NH4+)>c(Cl-)=c(H+)>c(OH-)
C.c(NH4+)>c(OH-)>c(Cl-)>c(H+) D.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
(4)在室温下,0.05 molL-1的NaCN溶液的pH约为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com