
【题目】已知常温下几种弱酸或弱碱的电离平衡常数(Ka或Kb)如下表所示:
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HCN | 5×10-10 |
NH3H2O | 1.8×10-5 |
H2SO3 | K1=1.5×10-2,K2=1.1×10-7 |
回答下列问题:
(1)CH3COONH4的水溶液呈中性,其理由是_____________,溶液中各离子浓度大小的关系是___________________。
(2)等物质的量浓度的下列五种溶液:①NH3H2O ②(NH4)2SO3 ③NaHSO3 ④Na2SO3
⑤H2SO3溶液中水的电离程度由大到小的排列顺序为________(填序号)。
(3)向25 mL 0.10 molL-1盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是________(填字母)。
A.c(Cl-)=c(NH4+)>c(H+)=c(OH-) B. c(NH4+)>c(Cl-)=c(H+)>c(OH-)
C.c(NH4+)>c(OH-)>c(Cl-)>c(H+) D.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
(4)在室温下,0.05 molL-1的NaCN溶液的pH约为________。
【答案】NH4+、CH3COO-的水解程度相同 c(NH4+)=c(CH3COO-)>c(H+)=c(OH-) ②④③①⑤ AC 11
【解析】
(1)根据盐的水解规律分析;利用电荷守恒比较离子浓度大小;
(2)酸溶液和碱溶液抑制了水的电离,能够水解的盐溶液促进了水的电离,结合亚硫酸和一水合氨的电离平衡常数进行判断;
(3)根据电荷守恒、物料守恒、质子守恒,结合溶液的酸碱性判断溶液中离子浓度关系;
(4)室温下0.05mol/L NaCN溶液中存在水解平衡,CN-+H2O![]() HCN+OH-,Kh=
HCN+OH-,Kh=![]() 计算。
计算。
(1) CH3COONH4是弱酸弱碱盐,在水溶液中盐电离产生的NH4+、CH3COO-发生水解反应,NH4+水解消耗OH-,产生H+,使溶液显酸性;而CH3COO-发生水解反应消耗H+,产生OH-,根据醋酸、一水合氨的电离平衡常数相等,可知NH4+、CH3COO-水解程度相同,因此最终溶液中c(H+)=c(OH-),所以溶液呈中性,根据电荷守恒可知:c(NH4+)+c(H+)=c(OH-)+c(CH3COO-),由于溶液呈中性,c(H+)=c(OH-),所以c(NH4+)=c(CH3COO-),但水是弱电解质,其电离产生的H+、OH-浓度很小,远小于盐电离产生的离子浓度,因此该溶液中离子浓度大小关系c(NH4+)=c(CH3COO-)> c(H+)=c(OH-);
(2)等物质的量浓度的下列五种溶液:①NH3H2O;②(NH4)2SO3;③NaHSO3;④Na2SO3;⑤H2SO3,①和⑤都抑制了水的电离,其中⑤亚硫酸的电离平衡常数大于①氨水,则⑤中水的电离程度小于①;③中亚硫酸氢根离子的电离程度大于其水解程度,溶液显示弱酸性,抑制了水的电离;②中亚硫酸根离子、铵根离子促进了水的电离;④中亚硫酸根离子促进了水的电离,其中②中水的电离程度大于④,所以五种溶液水的电离程度由大到小的排列顺序为:②④③①⑤;
(3)A.根据电荷守恒,如溶液呈中性,c(H+)=c(OH-),则有c(Cl-)=c(NH4+),盐电离产生的离子浓度大于水电离产生的离子浓度,所以离子浓度可以符合关系:c(Cl-)=c(NH4+)>c(H+)=c(OH-),A正确;
B.若氨水稍稍过量时:c(NH4+)>c(Cl-)=c(OH-)>c(H+),若盐酸稍过量, c(Cl-)>c(NH4+)=c(H+)>c(OH-),B错误;
C.体系为NH4Cl溶液和NH3·H2O,氨水过量较多时,溶液呈碱性:c(NH4+)>c(OH-)>c(Cl-)>c(H+), C正确;
D.盐酸电离出的c(Cl-)=c(H+),氢离子被氨水中和一部分,所以c(H+)不可能大于c(Cl-),D错误;
故合理选项是AC;
(4)室温下0.05mol/L NaCN溶液中存在水解平衡,CN-+H2O![]() HCN+OH-,Kh=
HCN+OH-,Kh= ![]() =2×10-5;Kh=
=2×10-5;Kh=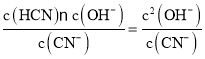 ,c2(OH-)=Khc(CN-)=2×10-5×0.05=10-6,所以c(OH-)=10-3mol/L,则溶液中c(H+)=10-11mol/L,因此溶液的pH=11。
,c2(OH-)=Khc(CN-)=2×10-5×0.05=10-6,所以c(OH-)=10-3mol/L,则溶液中c(H+)=10-11mol/L,因此溶液的pH=11。


科目:高中化学 来源: 题型:
【题目】碳、氮、硫的化合物在生产生活中广泛存在。请回答:
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH=-160.5 kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
写出CO2与NH3合成尿素和气态水的热化学反应方程式____________。
(2)T1温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)![]() 2NO2(g) H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),
2NO2(g) H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),
k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①从0~2s该反应的平均速率v(NO2)=___________。
②T1温度时化学平衡常数K=___________mol-1·L。
③化学平衡常数K与速率常数k正、k逆的数学关系是K=___________。若将容器的温度改变为T2时其k正=k逆,则T1__________T2 (填“>”、“<”或“=”)。
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是____________________(写出主要反应的离子方程式),该溶液中,c(Na+)______2c(SO32-)+c(HSO3-)(填“>”“<”或“=”)。
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO32-的第一步水解平衡常数=________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的两种氧化物在化工生产中都有着重要的用途。
I.CuO可用于制备Cu2O。
已知:①2Cu2O(s)![]() 4Cu(s)+O2(g) △H1=+338kJ·mol-1;
4Cu(s)+O2(g) △H1=+338kJ·mol-1;
②2CuO(s)![]() 2Cu(s)+O2(g) △H2=+314kJ·mol-1。
2Cu(s)+O2(g) △H2=+314kJ·mol-1。
(1)CuO分解生成2molCu2O的热化学方程式为___。
(2)温度为T时,向5L恒容密闭容器中加入80gCuO制备Cu2O,5min时恰好达到平衡,测得容器中Cu2O的物质的量为0.4mol。
①该反应的平衡常数K=___。
②5min时缩小容器容积,重新达到平衡时O2的浓度___(填“增大”、“减小”或“不变”)。
(3)研究表明,在CuO中加入适量碳粉有利于制得纳米级Cu2O,下列说法正确的是___(填选项字母)。
A.碳与氧气反应放热,加快反应速率 B.生成CO气体,使固体颗粒容易分散
C.CO可以将Cu2O还原为铜粉 D.CO作该反应的催化剂
Ⅱ.CuO可用于冶炼铜(已知:CO的燃烧热△H=—283kJ·mol-1);一定条件下,将1molCuO和0.5molCO加入2L密闭容器中发生反应,t1时达到平衡,t2后改变容器中的条件,用CO表示的反应速率(v)与时间(t)的关系如图所示(三个阶段改变的条件为温度、压强、浓度中的一个)。
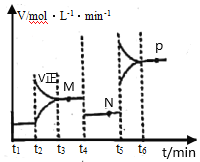
(4)t4时改变的条件为___。
(5)M、N、P三点对应状态下,CO的转化率a(M)、a(N)、a(P)的大小关系为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101 ℃,易溶于水,受热脱水、升华,170 ℃以上分解。回答下列问题:

(1)装置C中可观察到的现象是_________________________________,装置B的主要作用是________。
(2)请设计实验验证草酸的酸性比碳酸强____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的综合利用有如下转化关系。CO和H2按不同比例可分别合成A和B,已知烃A对氢气的相对密度是14,B能发生银镜反应,C为常见的酸味剂。

请回答:
(1)有机物D中含有的官能团的名称为______________。
(2)反应⑥的类型是______________。
(3)反应④的方程式是_______________________________________。
(4)下列说法正确的是________。
A.有机物A能使溴水和酸性高锰酸钾溶液褪色
B.有机物B和D能用新制碱性氢氧化铜悬浊液鉴别
C.有机物C、D在浓H2SO4作用下制取CH3COOCH2CH3,该反应中浓H2SO4是催化剂和氧化剂
D.有机物C没有同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取金属镁的工艺流程可简单图示如下:

(1)步骤①的目的是将海水中的Mg2+沉淀为Mg(OH)2,若浓缩海水中c(Mg2+)=2.0 mol·L-1,Mg2+开始形成沉淀时溶液的pH约为________(已知Ksp[Mg(OH)2]=1.8×10-11,log3=0.48)
(2)步骤③的操作由蒸发浓缩,______,过滤,_______四个环节组成。
(3)步骤④是在HCl气流中加热晶体得到无水MgCl2,简要说明HCl气体的作用_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解NaHSO4溶液制备Na2S2O8。电解时,阴极材料为Pb;阳极(铂电极)电极反应式为2HSO4-- 2e-=S2O82-+2H+。下列说法正确的是( )
A. 阴极电极反应式为Pb+HSO4-- 2e-=PbSO4+H+
B. 阳极反应中S的化合价升高
C. S2O82-中既存在非极性键又存在极性键
D. 可以用铜电极作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖
B.室温下,将![]() HA溶液和
HA溶液和![]() 溶液等体积混合
溶液等体积混合![]() 忽略体积的变化
忽略体积的变化![]() 测得混合溶液的
测得混合溶液的![]() ,则混合溶液中由水电离出的
,则混合溶液中由水电离出的![]()
C.纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于![]() 时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同素异形体
时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同素异形体
D.已知![]() 的
的![]() 为
为![]() ,则将等体积的
,则将等体积的![]()
![]() 的
的![]() 溶液和
溶液和![]()
![]()
![]() 溶液混合后会有
溶液混合后会有![]() 沉淀产生
沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】看图回答下列问题。

(1)钢铁的电化学腐蚀原理如图所示:
①该电化学腐蚀称为_____反应的负极反应式:____________
②为了利用电解池原理保护铁电极,要在如图的虚线方框内加上直流电源,铁应与电源的_____(填负或正)极相连,并写出石墨电极的电极反应式________________
③把如图中NaCl溶液用盐酸代替,则石墨电极产生的现象_________
(2)利用电镀原理在铁件表面镀铜。装置如图所示:
①电镀时镀件作______(填阳或阴)极
②A电极的电极反应式是_______
③若电镀前铁、铜两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量, 二者质量差为1.28 g,则电镀时电路中通过的电子为_____________mol。
(3)如图所示进行粗铜(含Al、Zn、Ag、Au等杂质)的电解精炼,下列说法正确的是________
a.阴极得到电子数为![]() 个,则阳极质量减少64g
个,则阳极质量减少64g
b.粗铜接A极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Au金属
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com