
【题目】图甲是一种利用微生物将废水中的尿素(CO(NH2)2)转化为环境友好物质的原电池装置示意图甲,利用该电池在图乙装置中的铁上镀铜。下列说法正确的是( )

A.图乙中Fe电极应与图甲中Y相连接
B.图甲中H+透过质子交换膜由右向左移动
C.图甲中M电极反应式:CO(NH2)2 +5H2O -14e = CO2+2NO2+14H+
D.当图甲中N电极消耗0.5 mol O2时,图乙中阴极增重64g
【答案】D
【解析】
该装置是将化学能转化为电能的原电池,由甲图可知,M上有机物失电子是负极,N上氧气得电子是正极,电解质溶液为酸性溶液,图乙中在铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极相连;
A.在铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极相连,则Fe与X相连,故A错误;
B.由甲图可知,氢离子向正极移动,即H+透过质子交护膜由左向右移动,故B错误;
C.H2NCONH2在负极M上失电子发生氧化反应,生成氮气、二氧化碳和水,电极反应式为CO(NH2)2+H2O-6e-═CO2↑+N2↑+6H+,故C错误;
D.当图甲中N电极消耗0.5 mol O2时,转移电子的物质的量为0.5mol×4=2.0mol,则乙中阴极增重![]() ×64g/mol=64g,故D正确;
×64g/mol=64g,故D正确;
故答案为D。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】右图为实验室制取乙酸乙酯的装置。

请回答:
(1)检验该装置气密性的方法是_________________________________。
(2)浓硫酸的作用是__________________。
(3)下列有关该实验的说法中,正确的是________。
A.向a试管中加入沸石,其作用是防止加热时液体爆沸
B.饱和碳酸钠溶液可以除去产物中混有的乙酸
C.乙酸乙酯是一种无色透明、密度比水大的油状液体
D.若原料为CH3COOH和CH3CH218OH,则乙酸乙酯中不含18O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一如下:
FeO(固)+CO(气)Fe(固)+CO2(气)ΔH>0
(1)则该反应中平衡常数表达式K=_________________
(2)已知1100℃时K=0.263。温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值_______平衡常数K值___(均填增大,减小或不变).
(3)1100℃时测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1,在这种情况下,该反应是否处于平衡状态________(选填是或否),此时化学反应速率v正____v逆(选填>,<,=)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温,下列溶液中各浓度关系不正确的是
A. 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液pH>7,则一定有:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
B. 1L0.1molL-1CuSO4·(NH4)2SO46H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
C. 0.1molL-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)≠c(HCO3-)+c(CO32-)+c(OH-)
D. 物质的量浓度分别为c1和c2的两种醋酸溶液,若其pH分别为a和a+1,则c1>10c2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在298 K条件下,2mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )。
A.2H2(g) + O2(g) = 2H2O(1) △H = - 484 kJ·mol-1
B.H2O(g) = H2(g) + ![]() O2(g) △H = + 242 kJ·mol-1
O2(g) △H = + 242 kJ·mol-1
C.H2(g) + ![]() O2(g) = H2O(g) △H = + 242 kJ·mol-1
O2(g) = H2O(g) △H = + 242 kJ·mol-1
D.2H2(g) + O2(g) = 2H2O(g) △H = + 484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、硫的化合物在生产生活中广泛存在。请回答:
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH=-160.5 kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
写出CO2与NH3合成尿素和气态水的热化学反应方程式____________。
(2)T1温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)![]() 2NO2(g) H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),
2NO2(g) H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),
k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①从0~2s该反应的平均速率v(NO2)=___________。
②T1温度时化学平衡常数K=___________mol-1·L。
③化学平衡常数K与速率常数k正、k逆的数学关系是K=___________。若将容器的温度改变为T2时其k正=k逆,则T1__________T2 (填“>”、“<”或“=”)。
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是____________________(写出主要反应的离子方程式),该溶液中,c(Na+)______2c(SO32-)+c(HSO3-)(填“>”“<”或“=”)。
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO32-的第一步水解平衡常数=________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病。工业上利用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取As2O3的工艺流程如下:
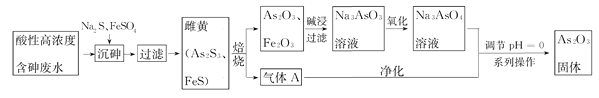
已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS32-
2AsS32-
回答下列问题:
(1)H3AsO3是一种两性偏酸性的化合物,As元素的化合价为_____________。
(2)“沉砷”中FeSO4的作用是________________________。
(3)“焙烧”过程产生的气体A的化学式为____________,检验该气体常用试剂为___________。
(4)调节pH=0时,发现酸性越强,As2O3的产率越高。可能的原因是__________________。获得As2O3固体,系列操作是________、______、_______。
(5)残留废渣中少量砒霜(As2O3)可以用双氧水氧化成H3AsO4而除去,该反应的化学方程式为:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的综合利用有如下转化关系。CO和H2按不同比例可分别合成A和B,已知烃A对氢气的相对密度是14,B能发生银镜反应,C为常见的酸味剂。

请回答:
(1)有机物D中含有的官能团的名称为______________。
(2)反应⑥的类型是______________。
(3)反应④的方程式是_______________________________________。
(4)下列说法正确的是________。
A.有机物A能使溴水和酸性高锰酸钾溶液褪色
B.有机物B和D能用新制碱性氢氧化铜悬浊液鉴别
C.有机物C、D在浓H2SO4作用下制取CH3COOCH2CH3,该反应中浓H2SO4是催化剂和氧化剂
D.有机物C没有同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com