
【题目】下列有关溶液中离子存在和转化表述不正确的是
A.常温下水电离出的c(H+)=1×1012 mol/L的溶液中不可能大量存在:Al3+、![]() 、Cl、S2
、Cl、S2
B.加入铝粉能产生H2的溶液中可能大量存在:Na+、Cl-、S2-、![]()
C.过量铁粉与稀HNO3反应:3Fe+8H++2![]()
![]() 3Fe2++2NO↑+4H2O
3Fe2++2NO↑+4H2O
D.向AlCl3溶液中滴入大量氨水:Al3++4NH3·H2O![]()
![]() +4
+4![]() +2H2O
+2H2O
【答案】D
【解析】
A. 常温下水电离出的c(H+)=1×1012 mol/L的溶液,可以是酸溶液,也可以是碱溶液;
B. 加入铝粉能产生H2的溶液,可以是酸溶液,也可以是碱溶液;
C. 铁粉与硝酸反应生成硝酸铁,过量的铁粉与硝酸铁继续反应,生成硝酸亚铁;
D. 氢氧化铝只能溶于强碱,不能溶于弱碱。
A. 常温下水电离出的c(H+)=1×1012 mol/L的溶液,可以是酸溶液,也可以是碱溶液;酸性溶液中H+与S2生成弱电解质不能共存,碱性溶液中OH-与Al3+、![]() 均不能共存,A项正确,不符合题意;
均不能共存,A项正确,不符合题意;
B. 加入铝粉能产生H2的溶液,可以是酸溶液,也可以是碱溶液,酸性溶液中H+与S2-、![]() 不能大量共存,碱性溶液中所有离子能共存,因此加入铝粉能产生H2的溶液中可能大量存在:Na+、Cl-、S2-、
不能大量共存,碱性溶液中所有离子能共存,因此加入铝粉能产生H2的溶液中可能大量存在:Na+、Cl-、S2-、![]() ,B项正确,不符合题意;
,B项正确,不符合题意;
C. 铁粉与硝酸反应生成硝酸铁,过量的铁粉与硝酸铁继续反应,生成硝酸亚铁,离子方程式为:3Fe+8H++2![]()
![]() 3Fe2++2NO↑+4H2O,C项正确,不符合题意;
3Fe2++2NO↑+4H2O,C项正确,不符合题意;
D. 向AlCl3溶液中滴入大量氨水,反应生成氢氧化铝和氯化铵,离子方程式为:Al3++3NH3·H2O![]() Al(OH)3↓+3NH4+,D项错误,符合题意;
Al(OH)3↓+3NH4+,D项错误,符合题意;
答案选D。


科目:高中化学 来源: 题型:
【题目】已知A—O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。请回答下列问题:
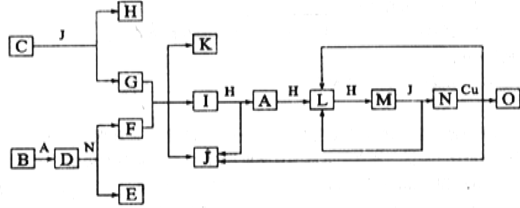
⑴组成B单质的元素位于周期表位置________________。化合物C电子式为____________。
⑵J的熔沸点比硒化氢(H2Se)的熔沸点高,其原因是_________________。
⑶I与H在一定条件下也可直接反应生成L和J, 写出化学方程式:_______________。
⑷写出D与水反应的化学方程式:_____________________。
⑸红棕色污染气体M的处理具有实际意义。现在常利用反应![]() (方程没配平)来处理M。当转移0.4mol电子时,消耗的M在标准状况下是_______L。
(方程没配平)来处理M。当转移0.4mol电子时,消耗的M在标准状况下是_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在实验室模拟工业上以预处理后的铬铁矿粉![]() 主要成分
主要成分![]() ,含少量
,含少量![]() 为原料制备
为原料制备![]() 并测定纯度,设计如下实验。回答下列问题:
并测定纯度,设计如下实验。回答下列问题:
Ⅰ![]() 煅烧铬铁矿粉。
煅烧铬铁矿粉。

已知:煅烧时,![]() 转化为
转化为![]() 。
。
(1)盛放![]() 的仪器名称为________装置B的作用为________。
的仪器名称为________装置B的作用为________。
(2)![]() 不能选用玻璃容器的原因为________。
不能选用玻璃容器的原因为________。
(3)实验时,a中所得产物除![]() 外还有一种红棕色固体,且观察到澄清石灰水变浑浊,则a中发生氧化还原反应的化学方程式为________。
外还有一种红棕色固体,且观察到澄清石灰水变浑浊,则a中发生氧化还原反应的化学方程式为________。
Ⅱ![]() 制备
制备![]() 。
。
(4)实验结束后,冷却至室温。取a中固体加水溶解,调节溶液的pH为![]() ;过滤,调节滤液的
;过滤,调节滤液的![]() ,蒸发浓缩、降温结晶,过滤、洗涤,得
,蒸发浓缩、降温结晶,过滤、洗涤,得![]() 粗品。
粗品。
①调节溶液的pH为![]() 后,第一次过滤,所得沉淀的成分为________
后,第一次过滤,所得沉淀的成分为________![]() 填化学式
填化学式![]() 。
。
②过滤所用主要玻璃仪器有________。
③结合离子方程式说明调节滤液的![]() 的目的为________。
的目的为________。
Ⅲ![]() 测定粗品中
测定粗品中![]() 的质量分数。
的质量分数。
(5)称取![]() 粗品,溶于适量水,酸化后配成100mL溶液;取
粗品,溶于适量水,酸化后配成100mL溶液;取![]() 所配溶液,滴加几滴指示剂,用
所配溶液,滴加几滴指示剂,用![]() 标准
标准![]() 溶液滴定至终点
溶液滴定至终点![]() 杂质不参加反应,还原产物为
杂质不参加反应,还原产物为![]() ,消耗标准液的体积为VmL。粗品中
,消耗标准液的体积为VmL。粗品中![]() 的质量分数为___
的质量分数为___![]() 用含c、m、V的代数式表示
用含c、m、V的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+HI(g)
H2(g)+HI(g)
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下,反应①的平衡常数为
A.9B.16C.20D.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一如下:
FeO(固)+CO(气)Fe(固)+CO2(气)ΔH>0
(1)则该反应中平衡常数表达式K=_________________
(2)已知1100℃时K=0.263。温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值_______平衡常数K值___(均填增大,减小或不变).
(3)1100℃时测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1,在这种情况下,该反应是否处于平衡状态________(选填是或否),此时化学反应速率v正____v逆(选填>,<,=)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应m A(g)+n B(g) ![]() p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )

A.T1<T2 p1>p2 m+n>p 放热反应B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温,下列溶液中各浓度关系不正确的是
A. 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液pH>7,则一定有:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
B. 1L0.1molL-1CuSO4·(NH4)2SO46H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
C. 0.1molL-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)≠c(HCO3-)+c(CO32-)+c(OH-)
D. 物质的量浓度分别为c1和c2的两种醋酸溶液,若其pH分别为a和a+1,则c1>10c2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、硫的化合物在生产生活中广泛存在。请回答:
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH=-160.5 kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
写出CO2与NH3合成尿素和气态水的热化学反应方程式____________。
(2)T1温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)![]() 2NO2(g) H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),
2NO2(g) H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),
k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①从0~2s该反应的平均速率v(NO2)=___________。
②T1温度时化学平衡常数K=___________mol-1·L。
③化学平衡常数K与速率常数k正、k逆的数学关系是K=___________。若将容器的温度改变为T2时其k正=k逆,则T1__________T2 (填“>”、“<”或“=”)。
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是____________________(写出主要反应的离子方程式),该溶液中,c(Na+)______2c(SO32-)+c(HSO3-)(填“>”“<”或“=”)。
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO32-的第一步水解平衡常数=________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的两种氧化物在化工生产中都有着重要的用途。
I.CuO可用于制备Cu2O。
已知:①2Cu2O(s)![]() 4Cu(s)+O2(g) △H1=+338kJ·mol-1;
4Cu(s)+O2(g) △H1=+338kJ·mol-1;
②2CuO(s)![]() 2Cu(s)+O2(g) △H2=+314kJ·mol-1。
2Cu(s)+O2(g) △H2=+314kJ·mol-1。
(1)CuO分解生成2molCu2O的热化学方程式为___。
(2)温度为T时,向5L恒容密闭容器中加入80gCuO制备Cu2O,5min时恰好达到平衡,测得容器中Cu2O的物质的量为0.4mol。
①该反应的平衡常数K=___。
②5min时缩小容器容积,重新达到平衡时O2的浓度___(填“增大”、“减小”或“不变”)。
(3)研究表明,在CuO中加入适量碳粉有利于制得纳米级Cu2O,下列说法正确的是___(填选项字母)。
A.碳与氧气反应放热,加快反应速率 B.生成CO气体,使固体颗粒容易分散
C.CO可以将Cu2O还原为铜粉 D.CO作该反应的催化剂
Ⅱ.CuO可用于冶炼铜(已知:CO的燃烧热△H=—283kJ·mol-1);一定条件下,将1molCuO和0.5molCO加入2L密闭容器中发生反应,t1时达到平衡,t2后改变容器中的条件,用CO表示的反应速率(v)与时间(t)的关系如图所示(三个阶段改变的条件为温度、压强、浓度中的一个)。
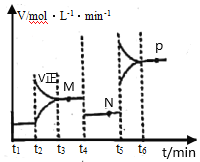
(4)t4时改变的条件为___。
(5)M、N、P三点对应状态下,CO的转化率a(M)、a(N)、a(P)的大小关系为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com