
【题目】MnSO4H2O是一种易溶于水的微红色斜方晶体,某同学设计下列装置制备硫酸锰:下列说法错误的是
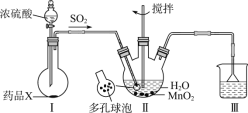
A.装置I烧瓶中放入的药品X为Na2SO3
B.装置II中用“多孔球泡”可增大SO2的吸收速率
C.装置Ⅲ烧杯中溶液为饱和NaHSO3
D.用装置II反应后的溶液制备MnSO4H2O需经历蒸发浓缩、冷却结晶、过滤洗涤干燥等过程
【答案】C
【解析】
由实验装置可知,X为亚硫酸钠,与浓硫酸反应生成二氧化硫,而Cu与浓硫酸常温下不反应;II中“多孔球泡”可增大SO2的吸收速率,二氧化硫与二氧化锰反应生成MnSO4,蒸发浓缩、冷却结晶可得到晶体,Ⅲ中NaOH溶液可吸收尾气,以此来解答。
A.Cu与浓硫酸反应制取SO2需要加热,装置图中无加热装置,所以X不可能为Cu;亚硫酸钠,与浓硫酸发生复分解反应生成硫酸钠、水、二氧化硫,所以装置I烧瓶中放入的药品X为Na2SO3,A正确;
B.装置Ⅱ中用“多孔球泡”,增大接触面积,可增大SO2的吸收速率,B正确;
C.SO2是有毒气体,不能随意排入大气,可根据SO2是酸性氧化物,能够与碱反应的性质除去,所以Ⅲ中NaOH溶液可吸收尾气,而饱和NaHSO3溶液不可吸收尾气,C错误;
D.用装置Ⅱ反应后的溶液为MnSO4,制备MnSO4H2O,通过蒸发结晶、过滤、洗涤及干燥可得到,D正确;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】有关①100mL 0.1 mol/L![]() 、②100mL 0.1 mol/L
、②100mL 0.1 mol/L![]() 两种溶液的叙述不正确的是
两种溶液的叙述不正确的是
A.溶液中水电离出的![]() 个数:②>①B.溶液中阴离子的物质的量浓度之和:②>①
个数:②>①B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:![]() D.②溶液中:
D.②溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(要求写出计算过程)现有一定温度下的密闭容器中存在如下反应:2SO2(g) + O2(g)![]() 2SO3(g),已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L,经测定该反应在该温度下的平衡常数K≈19,试判断:
2SO3(g),已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L,经测定该反应在该温度下的平衡常数K≈19,试判断:
(1)当SO2转化率为50%时,该反应是否达到平衡状态?________,若未达到,哪个方向进行?__________
(2)达平衡状态时, SO2的转化率应为________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置如图所示。下列说法中,错误的是( )。

A.燃料电池中通入氢气一端的多孔电极为负极
B.燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4 OH-
C.该燃料电池的总反应式为:2H2+O2=2H2O
D.乙装置可实现将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如下图所示的装置进行实验(夹持仪器略去),其中a、b、c中分别盛有试剂1、2、3,能达到实验目的的是
选项 | 试剂1 | 试剂2 | 试剂3 | 实验目的 | 装置 |
A | 浓盐酸 | MnO2 | 饱和NaCl溶液 | 制备纯净的Cl2 |
|
B | 浓 HNO3 | Cu片 | KI--淀粉溶液 | 验证NO2的氧化性 | |
C | 稀硫酸 | 溶液X | 澄淸石灰水 | 验证X中是否有CO32- | |
D | 稀硫酸 | FeS | 酸性KMnO4溶液 | 验证H2S具有还原性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pNi= -lg c(Ni2+),常温下H2S的电离平衡常数:Kal=l. 3×10-7,Ka2=7. 1×10-15。常温下,向10 mL 0. 1 molL-1Ni(NO3)2溶液中滴加0.1 molL-1Na2S溶液,滴加过程中pNi与Na2S溶液体积的关系如图所示。下列说法正确的是
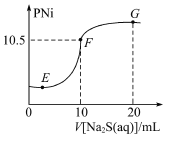
A.E、F、G三点中,F点对应溶液中水电离程度最大
B.常温下,Ksp(NiS) = 1×10-21
C.Na2S溶液中 c(S2- )+c(HS- )+c(H2S) =c(Na+)
D.Na2S溶液中,S2-第一步水解常数Kh1=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠。
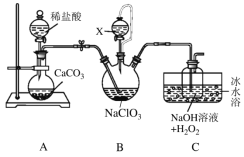
已知:①ClO2沸点为9.9℃,可溶于水,有毒,浓度较高时易发生爆炸。
②NaClO2饱和溶液低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解为NaClO3和NaCl。
③B装置为ClO2发生装置,所用试剂NaClO3、H2SO4(浓)、CH3OH。
请回答下列问题:
(1)装置B中试剂X的名称为___________;盛放该试剂的仪器的名称为________________。
(2)实验过程中需持续通入一定量的CO2,其目的是______________;反应结束后需再通入一定量的CO2,其目的是_____________________。
(3)装置C中的水浴温度应控制在____________________(填温度范围);装置C中生成NaClO2的离子方程式为___________________。
(4)上述装置存在一处明显的缺陷,其改进措施为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是铜-锌原电池示意图。下列有关该原电池的描述中正确的是( )

A.锌片作正极,不断溶解
B.铜片作负极,有气泡产生
C.负极反应:Zn2++2e-=Zn
D.正极反应:2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A.NaHSO4在熔融状态下的电离方程式:NaHSO4=Na++HSO4-
B.H2SO4溶液与NaOH溶液发生中和反应的热化学方程式为(已知H2SO4 溶液与NaOH溶液发生反应的中和热为57.3 kJ/mol):H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq) △H=-57.3kJ/mol
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的沉淀溶解平衡方程式:CaCO3(s)=Ca2+(aq)+CO32-(aq)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com