
科目: 来源: 题型:
【题目】在工业生产上中,主要用Na2SO3制造亚硫酸纤维素酯、硫代硫酸钠、有机化学药品、漂白织物等。但Na2SO3在空气中易氧化为Na2SO4而变质。为了求出变质样品中Na2SO3的含量,采用0.2 mol·L-1KMnO4酸性溶液滴定用样品配制的溶液。反应离子方程式是:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O,称取20 g样品,配成250 mL溶液,量取25 mL进行滴定,记录数据,再重复2次实验。
填空完成问题:
(1)滴定实验不需要下列仪器中的________。
A.酸式滴定管(50 mL) B.碱式滴定管(50 mL) C.量筒(10 mL) D.锥形瓶 E.铁架台 F.滴定管夹
G.白纸 H.玻璃棒
(2)已知滴定过程不需要指示剂,理由是_______________________。
(3)下列操作中可能使所测Na2SO3溶液的浓度数值偏低的是________(填字母)。
A.盛放Na2SO3溶液的滴定管没有使用Na2SO3溶液润洗
B.锥形瓶内有水残留,没有烘干,装入待测的Na2SO3溶液滴定
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
(4)滴定完毕,三次实验平均消耗0.2 mol·L-1KMnO4酸性溶液20.00mL,则样品中Na2SO3的百分含量为:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】非线性光学晶体在信息、激光技术、医疗、国防等领域具有重要应用价值。我国科学家利用Cs2CO3、XO2(X=Si、Ge)和H3BO3首次合成了组成为CsXB3O7的非线性光学晶体。回答下列问题:
(1)C、O、Si三种元素电负性由大到小的顺序为__________;第一电离能I1(Si) ____ I1(Ge)(填“>”或“<”)。
(2)基态Ge原子核外电子排布式为_____________;SiO2、GeO2具有类似的晶体结构,其中熔点较高的是________,原因是______。
(3)如图为H3BO3晶体的片层结构,其中B的杂化方式为________;硼酸在热水中比在冷水中溶解度显著增大的主要原因是_____________。
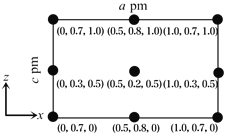
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。CsSiB3O7属于正交晶系(长方体形),晶胞参数为a pm,b pm和c pm。如图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为_______;CsSiB3O7的摩尔质量为M g·mol-1,设NA为阿伏加德罗常数的值,则CsSiB3O7晶体的密度为_____________g·cm-1(用代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为:CH3COOCH3(l)+C6H13OH(l)![]() CH3COOC6H13(l)+CH3OH(l)
CH3COOC6H13(l)+CH3OH(l)
已知v正=k正x(CH3COOCH3)x(C6H13OH),v逆=k逆x(CH3COOC6H13)x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
(1)反应开始时,已醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。
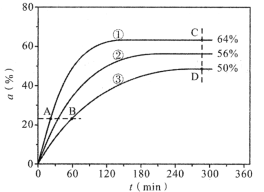
该醇解反应的ΔH____0(填>或<)。348K时,以物质的量分数表示的化学平衡常数Kx=____(保留2位有效数字)。在曲线①、②、③中,k正-k逆值最大的曲线是____;A、B、C、D四点中,v正最大的是___,v逆最大的是____。
(2)343K时,己醇和乙酸甲酯按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比____时,乙酸甲酯转化率最大;与按1:2投料相比,按2:1投料时化学平衡常数Kx___(填增大、减小或不变)。
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是____。
a.参与了醇解反应,但并不改变反应历程 b.使k正和k逆增大相同倍数
c.降低了醇解反应的活化能 d.提高乙酸甲酯的平衡转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】热催化合成氨面临的两难问题是:采用高温增大反应速率的同时会因平衡限制导致NH3产率降低。我国科研人员研制了Ti-H-Fe双温区催化剂(Ti-H区域和Fe区域的温度差可超过100℃)。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是( )

A. ①为N![]() N的断裂过程
N的断裂过程
B. ①②③在高温区发生,④⑤在低温区发生
C. ④为N原子由Fe区域向Ti-H区域的传递过程
D. 使用Ti-H-Fe双温区催化剂使合成氨反应转变为吸热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】25°C时,向10mL0.10mol·L-1的一元弱酸HA(Ka =1.0×10-3)中逐滴加入0.10mol·L-1NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。下列说法正确的是( )

A.a点时,c(HA)+c(OH-)=c(Na+)+c(H+)
B.溶液在a点和b点时水的电离程度相同
C.b点时,c(Na+)=c(HA)+c(A- )+c(OH-)
D.V =10mL时,c(Na+)>c(A-)>c(H+)>c(HA)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业制硫酸的反应原理主要有下列三个反应:
①FeS2(s)+O2(g)![]() Fe2O3(s)+SO2(g);ΔH1
Fe2O3(s)+SO2(g);ΔH1
②2SO2(g)+O2(g)![]() 2SO3(g); ΔH2
2SO3(g); ΔH2
③SO3+H2O=H2SO4
Ⅰ.(1)反应①配平后各物质系数分别为_____、______、_______、______。若每生成1molSO2时反应放热426.5kJ,则ΔH1=_______________。
(2)工业生产中将FeS2矿石粉碎后投入反应器中反应,这样做的目的是___________。
Ⅱ.下表是不同温度和压强下反应②中SO2的转化率
0.1Mp | 0.5Mp | 1Mp | 10Mp | |
400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
600℃ | 73.7 | 85.8 | 89.5 | 96.4 |
(3)反应②是气体体积缩小的可逆反应,增大压强有利于提高原料转化率,但工业生产中该反应在常压下进行,采用常压生产条件的理由是_______________________。
(4)若原料气组成:SO2 7%,O211%,N2 82%,在温度和压强不变的条件下,混合气体体积变为原来的97.2%,则SO2的转化率为_________。
Ⅲ.尾气中的二氧化硫对环境造成污染,需要处理后才能排放。常用亚硫酸钠吸收法。
(5)Na2SO3溶液吸收SO2的离子方程式为________________________ ;
(6)常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是____(填序号)
A.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
B.c(Na+)=c(SO32-)+c(HSO3-)+C(H2SO3)
C.c(Na+)>c(SO32-)>c(OH-)>c(H+)
D.水电离出c(OH-)=l×l0-8 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】根据要求完成下列各小题:
Ⅰ.(1)理论上稀的强酸、强碱反应生成1mol H2O(l)时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式________ 。
(2)已知:乙苯催化脱氢制苯乙烯反应:苯在计算键能时,此处可看作为![]() ,
, ![]()
![]()
![]() +H2(g)
+H2(g)
化学键 | C—H | C—C | C=C | H—H |
键能/kJ·mol-1 | 412 | 348 | 612 | 436 |
计算上述反应的ΔH=________ kJ·mol-1。
Ⅱ.25 ℃时,部分物质的电离平衡常数如表所示,请回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为_______。
(2)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下向10mL0.1mol·L-1NaOH溶液中加入0.1mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A.b点所示溶液中[A-]>[HA]
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,[Na+]=[A-]+[HA]
D.a点所示溶液中[Na+]>[A-]>[H+]>[HA]
查看答案和解析>>
科目: 来源: 题型:
【题目】下列方程式书写正确的是
A.NaHSO4在熔融状态下的电离方程式:NaHSO4=Na++HSO4-
B.H2SO4溶液与NaOH溶液发生中和反应的热化学方程式为(已知H2SO4 溶液与NaOH溶液发生反应的中和热为57.3 kJ/mol):H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq) △H=-57.3kJ/mol
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的沉淀溶解平衡方程式:CaCO3(s)=Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目: 来源: 题型:
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+,O2,NO3-等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量为ne。下列说法错误的是( )

A. 反应①②③④均在正极发生
B. 单位时间内,三氯乙烯脱去amolCl时ne=amol
C. ④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D. 增大单位体积水体中小粒径ZVI的投入量,可使nt增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com